Médecine personnalisée : changer le paradigme du soin ?
La médecine génomique s’impose aujourd’hui comme un véritable tournant pour la médecine et la société. À la croisée des avancées scientifiques, technologiques et économiques, elle redéfinit les standards de la prise en charge médicale et ouvre des perspectives inédites en matière de santé publique et d’innovation. Pour les acteurs du secteur, la maîtrise de cette révolution est un enjeu stratégique qui façonnera les systèmes de soins de demain.
La médecine personnalisée, souvent qualifiée de médecine de précision ou encore de médecine prédictive, marque un tournant majeur pour la médecine contemporaine. Elle repose sur l’exploitation fine des données biologiques, génétiques, cliniques et environnementales propres à chaque individu, afin d’anticiper, diagnostiquer et traiter les pathologies de manière plus ciblée. Ce changement de paradigme, appuyé sur les avancées en génomique, modifie profondément la façon dont on conçoit la santé, la maladie et l’acte de soigner.
À la croisée de la recherche biomédicale et des technologies de l’information, la médecine personnalisée s’est structurée au fil des décennies. Son émergence s’appuie sur la biologie moléculaire et le séquençage du génome humain, dont le coût a été drastiquement réduit depuis les années 2000. Grâce à cette évolution, les pratiques médicales peuvent désormais s’adapter aux caractéristiques spécifiques des patients. Si l’idée d’un soin ajusté au cas individuel n’est pas neuve, l’ampleur et la précision de cette adaptation, notamment en oncologie, laissent espérer de nouveaux progrès pour les patients.
Deux champs distincts structurent la génomique médicale : d’une part, la génétique constitutionnelle, qui concerne le patrimoine héréditaire d’un individu et relève d’un encadrement éthique et juridique strict ; d’autre part, la génétique somatique et la pharmacogénomique, qui analysent les mutations acquises dans les cellules malades et les réponses différenciées aux traitements. Ce second champ est au cœur de la médecine personnalisée en pratique clinique.
La notion de médecine des « 4P » – personnalisée, préventive, prédictive, participative – illustre les ambitions de cette approche. En intégrant des outils numériques, des objets connectés et de nouvelles formes de collecte de données, elle cherche à impliquer davantage les patients dans leur parcours de soin. Mais cette participation repose aussi sur une condition essentielle : la confiance dans l’usage et la protection des données personnelles, notamment génétiques. L’adhésion démocratique à ces pratiques, parfois complexes ou mal comprises, est un enjeu central pour leur déploiement.
En oncologie, domaine d’application le plus avancé, les thérapies ciblées reposent sur l’identification des altérations moléculaires des tumeurs. Elles permettent des traitements mieux tolérés et plus efficaces. Des initiatives françaises comme le programme Interception de Gustave Roussy ou l’usage croissant de la biopsie liquide illustrent la montée en puissance de cette médecine de précision, rendue possible par l’évolution rapide des technologies et la baisse des coûts.
Au-delà de l’amélioration des soins, la médecine personnalisée représente aussi un enjeu stratégique, économique et industriel. Elle favorise le développement d’une filière d’innovation biomédicale et numérique, tout en promettant une meilleure efficience du système de santé. Toutefois, l’évaluation médico-économique de ces interventions reste un défi. Les bénéfices attendus – en termes de survie, de qualité de vie ou de réduction des traitements inutiles – doivent être mieux quantifiés pour légitimer l’investissement public et renforcer la confiance des citoyens.
Introduction
Les catégories conceptuelles cardinales de la médecine, comme le soin, la maladie, la bonne santé ou bien la prévention, sont en passe d’être bouleversées par un nouveau paradigme scientifique et clinique, qu’on appelle médecine personnalisée, de précision ou encore prédictive. Experts et médias y voient volontiers une « révolution ». Le président de la République l’a dit lors de la présentation en 2021 de la Stratégie Innovation Santé 2030 : « nous vivons aujourd’hui une vraie révolution dans les domaines de la santé et des sciences de la vie » avec l’avènement de la « médecine du 21e siècle », « cette médecine plus personnalisée, plus efficace, plus prédictive, préventive et participative ».
Cette démarche de soin, dite personnalisée, change la donne de notre santé parce qu’elle s’appuie sur les informations cliniques, génétiques, génomiques et environnementales uniques de chaque personne. L’un de ses éléments-clés est la médecine génomique, qui consiste à utiliser les informations provenant des génomes et de leurs dérivés (ARN, protéines et métabolites) pour guider la prise de décision médicale, y compris en amont de toute expression pathologique.
Parce que vocabulaire, concepts et catégories sont complexes et, de surcroît, mouvants dans ce champ médico-scientifique en pleine évolution, il reste aujourd’hui difficile d’accès pour les amateurs, patients ou citoyens profanes, a priori bien en peine d’en comprendre vraiment les coordonnées. Pourtant, le récit d’une révolution en marche qui nous concerne tous est bel et bien omniprésent dans la discussion publique, porté par les acteurs privés et publics du secteur. Pareil horizon, annoncé donc pour changer la donne du soin dès aujourd’hui dans nos vies à tous, malades ou bien-portants, dépasse probablement en partie, par sa portée éthique et politique, le périmètre d’action et de réflexion de ceux qui en sont les experts légitimes. Il serait dommage que les progrès thérapeutiques qui s’annoncent, mal traduits ou cantonnés à la compréhension de quelques-uns, ne reçoivent pas le soutien qu’ils méritent du public ; le risque, en particulier, d’une polarisation primaire des représentations qui assimilerait par principe toute technicisation du soin à sa déshumanisation, mérite peut-être d’être prévenu. L’action publique, l’investissement et l’engagement des professionnels, dans ce domaine, aussi technique soit-il, ont besoin d’être portés par le soutien démocratique et la compréhension de tous ceux qu’ils servent. Le propos de ce texte est donc de proposer un essai de cartographie des termes de la discussion, première étape d’une conversation politique que l’on souhaite voir s’élargir à la hauteur de ses enjeux pour l’intérêt public.
Génétique, génomique et médecine personnalisée
La médecine qu’on appelle aujourd’hui « personnalisée » cherche à définir des groupes étroits de patients grâce à des biomarqueurs permettant de sélectionner les molécules les plus efficaces correspondant aux meilleures options thérapeutiques et au dosage optimal en fonction des caractéristiques biologiques et génétiques de la personne, de son mode de vie et de son environnement. Elle utilise de nouveaux outils technologiques, comme le séquençage du génome à haut, voire très haut débit.
La génétique est l’étude de l’hérédité, des gènes qui la sous-tendent et de l’interaction entre les gènes, les variations de l’ADN et les interactions avec les facteurs environnementaux. L’ensemble de l’ADN d’un individu est appelé génome. Pratiquement toutes les cellules du corps contiennent une copie complète des quelque 3 milliards de paires de bases ou lettres qui constituent le génome humain. Si l’ADN d’une cellule subit une mutation, cela peut perturber les processus habituels de l’organisme et conduire à une maladie, telle que le cancer. La génomique est l’étude de l’ADN d’une personne, de ses gènes et de la manière dont ils s’expriment et interagissent pour influencer la croissance, le développement et le fonctionnement de l’organisme. La médecine génomique peut permettre de mieux comprendre l’impact de notre patrimoine génétique sur notre santé et sur la réponse aux traitements.
Il existe aujourd’hui toute une série de technologies qui permettent de « séquencer » l’ensemble du génome humain ou d’en examiner des parties. Elles sont appliquées au diagnostic et au traitement de maladies rares, héréditaires mais aussi de certaines maladies courantes, ainsi qu’aux tissus cancéreux, au sang ou au liquide amniotique. Ces technologies recherchent des mutations ou des variantes du génome. Dans certains cas, il peut s’agir d’une mutation d’un seul gène, à l’origine de maladies telles que la mucoviscidose et la drépanocytose. Le plus souvent, la maladie résulte d’une combinaison complexe de facteurs génétiques et environnementaux, comme c’est le cas pour les cancers, les démences ou les maladies cardiovasculaires.
Distinguer génétique constitutionnelle et génétique somatique
L’une des difficultés de ce champ de connaissances tient sans doute au fait qu’il recouvre des pratiques, des aires cliniques et donc des enjeux scientifiques et éthiques très différents. Même s’ils partagent en l’espèce des concepts et des avancées communes, deux domaines de recherche et de soin doivent être distingués : d’une part, les tests qui apportent des informations sur le patrimoine génétique transmissible, présent dans toutes les cellules de l’organisme (génétique constitutionnelle), et de l’autre, les tests qui informent sur l’état du génome de cellules tumorales (génétique somatique). En outre, d’autres tests permettent d’obtenir des informations sur la réponse à un traitement ou sur les risques d’effets secondaires (pharmacogénomique).
Depuis la médiatisation de l’aventure du séquençage du génome humain, l’opinion publique associe l’idée de tests génétiques à la recherche des caractéristiques de génétique constitutionnelle (ou héréditaire) d’une personne, qui repose sur l’étude de son patrimoine génétique, le plus souvent à partir d’une prise de sang. Ils peuvent être réalisés avant la naissance (test prénatal) ou après, à n’importe quel âge (test postnatal). La génétique constitutionnelle est un champ de recherche et de soin extrêmement encadré en France. La loi interdit l’accès direct à ces tests en dehors du cadre médical (voir l’encadré ci-dessous). Des règles de bonne pratique concernant l’utilisation de ces tests et l’information à délivrer aux patients et à leur famille sont prévues par la loi de bioéthique et recommandées par l’Agence de biomédecine et la Haute autorité de santé. Le recours à ces tests est toujours assorti d’une consultation en génétique permettant d’éclairer le patient et sa famille sur l’intérêt du test et sur les conséquences éventuelles de son résultat (risque pour la descendance, pronostic vital menacé, suivi thérapeutique à mettre en place, interruption médicale de grossesse…). Le recours à ces tests est envisagé principalement en cas de symptôme pouvant évoquer une maladie génétique ou chez des personnes ne présentant aucun symptôme mais ayant un risque d’être porteurs d’une mutation associée à une maladie grave et désirant concevoir un enfant.
Les enjeux de la génétique somatique et de la pharmacogénétique, qui font l’objet de ce texte, sont distincts de ceux de la génétique constitutionnelle. Les tests de génétique somatique (non héréditaire) consistent à analyser le génome des cellules cancéreuses pour détecter des mutations survenues spécifiquement dans la tumeur et prédire la réponse à un traitement ciblé. La pharmacogénomique, quant à elle, consiste à étudier les caractéristiques génétiques d’un individu pour prédire la réponse de son organisme à un médicament : effets secondaires, risques de surdosages ou encore inefficacité. Ces tests permettent de détecter des variants génétiques associés à l’assimilation ou, au contraire, à la transformation/dégradation du médicament.
Tests génétiques direct-to-consumer : rien à voir avec le sujet Ces tests n’ont rien à voir avec ceux qui, comme le relatent fréquemment les médias, se vendent de plus en plus sur internet et qu’on appelle des tests génomiques direct-to-consumer (DTC). Ces tests, commercialisés pour une centaine d’euros par des entreprises internationales comme 23andMe, AncestryDNA ou MyHeritage, sont accessibles en ligne et peuvent être commandés par les consommateurs sans prescription médicale. Selon plusieurs médias, 1,5 million de Français y aurait déjà eu recours, principalement dans une visée « récréative » de généalogistes en herbe. La CNIL rappelait pourtant dans une alerte en mars 2024 que l’achat d’un test génétique sur Internet par des personnes résidant en France est interdit (art.226–28 du Code pénal), passible de 3 750 € d’amende, et que la réalisation d’un test génétique en dehors des domaines médical et scientifique est interdite et passible de 15 000 € d’amende et d’un an de prison pour les personnes ou entreprises proposant ces tests. Les tests sont expédiés depuis l’étranger, et les résultats sont communiqués par voie numérique, échappant ainsi à la régulation française. L’Agence de la biomédecine (ABM) considère que ces tests génétiques en accès libre sont en fait des tests de « susceptibilité », qui portent sur des maladies « multifactorielles », c’est-à-dire induites par d’autres facteurs que les seuls gènes. Ils ne permettent pas de diagnostic mais renseignent sur un ou des « facteurs de risques » pouvant être interprétés de façon très diverse et pouvant avoir des conséquences notamment personnelles et familiales graves (conduite suicidaire, abandon, isolement social…). Par ailleurs, il est globalement avancé par les scientifiques que la fiabilité de ces tests, et de leur interprétation, est préoccupante. |
La médecine génomique est une discipline clinique émergente qui consiste à utiliser les informations génomiques d’un individu dans le cadre de ses soins cliniques. Par exemple pour le diagnostic ou la prise de décision concernant les traitements. Elle a le potentiel de modifier les soins cliniques en se concentrant sur la cause sous-jacente de la maladie plutôt que sur l’organe dans lequel les symptômes peuvent apparaître[1].
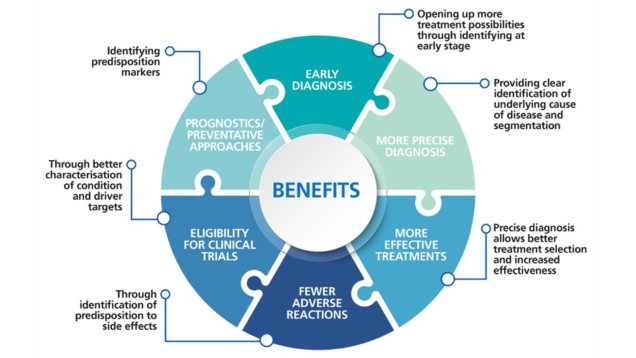
Source de la figure : NHS
Médecine des « 4P »
Ce changement de paradigme est en marche depuis plusieurs décennies. Après avoir transformé les catégories de pensée des chercheurs et des médecins, il est en passe de transformer l’organisation du parcours des patients. Au tournant des années 2000, sous la plume notamment d’Elias Zerhouni, directeur du NIH américain, le terme de « 4 P medicine » vient désigner une nouvelle vision de la médecine : personnalisée, préventive, prédictive et participative. Un « cinquième P » est venu s’ajouter plus récemment à la liste : on parle en outre de médecine « de précision ». Ce slogan des « 4P » fait désormais partie de la culture générale de tout médecin ; le souvenir de l’enthousiasme qu’il soulevait il y a vingt ans prend désormais les couleurs surannées d’une utopie visionnaire, remplacée par la réalité des avancées accomplies depuis pas à pas.
Médecine personnalisée, médecine de précision, médecine prédictive sont donc des appellations admises pour nommer la présente révolution, dont l’ingrédient fondamental est la capacité de tenir compte des particularités d’un individu, comme son profil génétique, en utilisant le nuage de données qui le concerne. C’est en effet l’individualisation du traitement qui est la signature de cette approche : la question n’est plus de savoir ce qui marche le mieux en moyenne dans une population donnée, mais de caractériser chaque situation individuelle afin d’y adapter avec précision une réponse sur mesure – idée que les définitions en anglais du terme « personalized medicine » ciblent en utilisant le plus souvent le verbe « tailor ».
Pour autant, il ne s’agit pas littéralement de créer des médicaments ou des dispositifs médicaux uniques pour chaque patient. Selon une définition qui fait référence, celle du President’s Council of Advisors on Science and Technology américain en 2008, l’idée est plutôt de « classer les individus en sous-populations qui diffèrent par leur susceptibilité à une maladie particulière, par la biologie ou le pronostic des maladies qu’ils peuvent développer, ou par leur réponse à un traitement spécifique. Les interventions préventives ou thérapeutiques peuvent alors être concentrées sur ceux qui en bénéficieront, évitant ainsi des coûts inutiles et des effets secondaires pour ceux qui n’en tireraient aucun avantage »[2].
L’émergence d’une révolution conceptuelle
On doit l’avènement de cette médecine à la convergence de plusieurs changements de paradigmes.
Le premier est une révolution scientifique : celle de la naissance de la biologie moléculaire puis du séquençage du génome humain. L’attribution du prix Nobel de médecine en 1965 à trois chercheurs français, André Lwoff, Jacques Monod et François Jacob, marque ici un tournant historique. Les trois chercheurs de l’Institut Pasteur ont ainsi découvert que nos gènes ne sont pas exprimés de manière constante au fil du temps, mais qu’ils sont régulés – c’est-à-dire activés ou réprimés – très finement, pour répondre aux besoins de notre organisme. Pourquoi les enzymes de la digestion ne sont-ils pas produits constamment mais seulement après un repas ? Pourquoi notre système immunitaire, dans des conditions normales, ne se met-il en marche qu’en cas de menace de l’organisme par des agents étrangers ? A ces questions, leur découverte apportait enfin une réponse. L’étude des régulations génétiques et de leurs dysfonctionnements, responsables de nombreuses maladies, est devenue centrale.
Un champ de forte compétition mondiale
La médecine génomique n’est plus une perspective lointaine mais une avancée concrète qui transforme en profondeur la prévention, le diagnostic, le traitement et le suivi des maladies. Son impact dépasse le seul cadre médical : elle représente un domaine stratégique au sein d’une compétition internationale intense, où chaque nation cherche à renforcer son industrie et attirer les meilleurs talents scientifiques pour asseoir son leadership.
Pour exploiter pleinement le potentiel de la médecine génomique, il est essentiel de renforcer le lien entre la recherche fondamentale et l’application clinique. Cela passe par l’analyse approfondie des mécanismes moléculaires des pathologies et par l’exploitation de vastes bases de données issues de sources variées : génomiques (séquençage, criblage), biologiques, cliniques et même environnementales. L’interconnexion de ces données hétérogènes permettra d’affiner les stratégies thérapeutiques et d’accélérer la mise au point de traitements innovants.
L’essor de la médecine génomique repose également sur une convergence entre les sciences du vivant et les technologies de l’information. La capacité à collecter, stocker, analyser et interpréter des volumes massifs de données devient un enjeu central. Cette révolution numérique ouvre la voie à une filière d’excellence en bio-informatique et en intelligence artificielle appliquée à la santé. Aux infrastructures de calcul intensif s’ajoutent des logiciels spécialisés en fouille de données et en modélisation, indispensables pour relever les défis de la médecine de précision.
Un enjeu économique majeur pour la politique de santé
L’essor de la médecine génomique implique de remodeler l’organisation des soins. Grâce au séquençage systématique du génome, de nombreux patients atteints de maladies rares ou de cancers bénéficient désormais d’un diagnostic et de traitements plus personnalisés. Mais les avancées ne se limitent pas aux pathologies rares : des affections chroniques plus courantes, métaboliques, cardiovasculaires ou neurologiques, profitent déjà de progrès significatifs au-delà des gènes de susceptibilité traditionnels. À mesure que de nouvelles indications cliniques sont validées, c’est l’ensemble du système de soins qui pourra tirer parti de cette évolution, garantissant une prise en charge toujours plus adaptée aux besoins des patients.
En cela, l’essor de la médecine génomique représente un enjeu économique majeur, tant en termes d’optimisation des coûts du système de santé que de création d’une nouvelle industrie. En améliorant la précision des diagnostics et des traitements, elle permet de réduire les dépenses inutiles : examens superflus, prescriptions inadaptées, délais d’analyse prolongés, effets secondaires évitables. Cette approche ciblée favorise une meilleure allocation des ressources médicales et améliore la qualité de vie des patients.
L’évaluation de l’intérêt médico-économique de la médecine génomique par rapport aux stratégies standards demeure toutefois un enjeu complexe. En général, lorsqu’une nouvelle intervention de santé est intégrée dans la pratique clinique, des analyses coûts-bénéfices minutieuses sont entreprises pour déterminer sa « valeur », c’est-à-dire pour mettre en regard de son coût les bénéfices attendus. Les critères utilisés pour déterminer cette valeur varient d’un pays à l’autre. En France, le Plan France médecine génomique 2015–2025 a fait du développement des connaissances médico-économiques dans ce champ une priorité scientifique, en s’appuyant notamment sur une contribution de l’Ecole d’économie de Toulouse (annexe 8 du Plan). A l’heure actuelle, le corpus de connaissances ne permet pas de définir la valeur directe et indirecte des bénéfices attendus de la médecine personnalisée. Les travaux en cours visent à considérer simultanément, à une échelle macro, deux chaînes de valeur : une valeur immédiate liée aux résultats espérés (amélioration de la prise en charge médicale en particulier thérapeutique des patients, gain en survie, etc.) et une valeur plus tardive et évolutive liée à l’exploitation d’autres données génomiques permettant progressivement une meilleure précision de l’acte médical se traduisant par un accroissement de l’efficacité thérapeutique, un gain en terme d’effets secondaires, un arrêt progressif de l’errance thérapeutique, etc.
Pour l’heure, dans une perspective d’évaluation coût-bénéfice, une méta-analyse publiée en 2023[3] a conclu sur un apport économique « nuancé » de la médecine génomique. Chen et al. ont analysé 275 papiers publiés entre 2011 et 2021 dans le but de quantifier de façon globale la value-for-money de la médecine de précision comparée à la médecine standard, en identifiant les domaines d’applications les plus prometteurs en termes de coût-efficacité. Reste que, de manière générale, les interventions de précision en oncologie figurent parmi celles qui fournissent le plus de value-for-money ; en poolant les études, les tests génomiques utilisés en tant que « compagnons » diagnostiques (pour orienter un traitement ciblé) présentaient un bénéfice monétaire net moyen d’environ 5 700 $ (p < 0,001), et même ~31 000 $ pour les panels multigéniques.
Le développement de ces connaissances médico-économiques reste crucial aujourd’hui. Comme le soulignait la philosophe Marie Gaille, directrice de l’institut des sciences humaines et sociales du CNRS dans un article de 2021 : « Pour promouvoir la confiance du public et son soutien à l’égard de la génomique, la « valeur » des données génomiques pour la science, la santé publique et l’économie doit être soigneusement examinée, et des études approfondies sont nécessaires pour s’assurer que les ressources sont allouées efficacement et au profit du bien commun »[4].
Participation des patients ou partage de leurs données ?
La médecine de précision entend reposer sur la participation plus active du patient dans le soin. Le leitmotiv issu de la loi Kouchner de 2002, le fameux « patient acteur de son parcours de soin », prend-il ici une densité nouvelle ? Le droit des patients à la participation active dans leur santé trouve en tous cas une traduction concrète nouvelle avec la place que la médecine personnalisée accorde aux objets connectés, à l’auto-mesure, aux outils de communication entre patients et professionnels de santé, et à l’implication du patient dans le monitoring de son traitement et le recueil partagé de ses propres données.
Cet horizon de participation modifie également en profondeur les pratiques de recherche, en faisant de chaque individu un producteur potentiel de données qui s’avèrent infiniment précieuses à la fois pour lui-même et pour l’intérêt de tous. C’est par exemple le sens du programme de recherche All of us conduit depuis 2015 par le NIH, qui rassemble 850.000 volontaires partageant leurs données sanitaires et génomiques. Sur son site, ce programme entend convaincre les citoyens de participer en vantant les promesses de la recherche participative et de la médecine personnalisée : « Trop souvent, les soins de santé sont des soins à taille unique. Les traitements conçus pour le patient « moyen » peuvent ne pas être efficaces pour certaines personnes. (…) All of Us s’efforce d’améliorer les soins de santé grâce à la recherche. Contrairement aux études qui se concentrent sur une seule maladie ou un seul groupe de personnes, All of Us constitue une base de données diversifiée qui peut servir de base à des milliers d’études sur une variété de problèmes de santé. Cela permet de multiplier les possibilités de connaître les facteurs de risque de certaines maladies, de déterminer les traitements les plus efficaces pour des personnes d’horizons différents, de mettre les gens en contact avec les études cliniques qui répondent à leurs besoins, et d’apprendre comment les technologies peuvent nous aider à prendre des mesures pour être en meilleure santé ».
L’objectif est d’offrir aux chercheurs une vaste base de données personnelles caractéristiques de multiples différences en termes de modes de vie et de comportements, d’environnement et de profils génétiques. Un outil clé pour mieux comprendre, notamment, les interactions entre expositions environnementales et facteurs génétiques dans la survenue des maladies, mais aussi par exemple pour déterminer les effets différentiels produits par les médicaments de la vie courante entre différentes personnes, ou encore pour tracer les marqueurs biologiques associés à la (non)survenue d’une maladie.
En France, Gustave Roussy développe depuis 2021 un programme appelé Interception qui « a pour objectif d’identifier au plus tôt les personnes à risque augmenté de nombreux cancers, afin de leur proposer une prévention sur-mesure et de mieux les prendre en charge », alors que « 30 à 40% des cancers se développent chez des personnes qui auraient pu être identifiées comme étant à risque augmenté des années plus tôt ». Ce programme de prévention personnalisée est aussi un enjeu majeur de recherche. Il est développé dans le cadre du programme Prism de Gustave Roussy, labellisé « Centre national de précision contre le cancer » par l’Agence nationale pour la recherche en 2018 et, depuis 2023, l’un des 5 IHU dotés de 30 à 40 millions d’euros dans le cadre du 3e appel à projets du plan France 2030.
L’objectif de PRISM est de « mieux comprendre la biologie du cancer de chaque patient et d’identifier dès le diagnostic ceux porteurs des tumeurs les plus agressives afin de leur proposer le traitement le plus adapté ». En son sein, Interception vise également à développer pour les années qui viennent de nouveaux modes de dépistage et prévention adaptés pour « éradiquer le cancer avant qu’il soit cliniquement détectable ». Plusieurs études cliniques structurent le programme, comme l’étude MyPeBS sur le dépistage personnalisé du cancer du sein, l’étude européenne 4-in-the-lung-run qui affine le dépistage du cancer du poumon par scanner ou l’étude LEAH qui évalue le rôle de l’ADN circulant en dépistage. « Nos équipes sont mobilisées pour faire avancer la recherche afin d’identifier de nouveaux biomarqueurs de risque, de nouvelles modalités de dépistage, de prévention ou d’interventions nutritionnelles. Nous poursuivons également l’exploration du rôle de l’immunité et du microbiote, et cherchons à développer une meilleure connaissance des impacts socio-psychologiques », explique Suzette Delaloge, à la tête de ce programme.
Pour Gustave Roussy, premier centre de lutte contre le cancer en France et en Europe, « Interception c’est la prévention de demain ! ». La portée de la « personnalisation » est claire dans ce programme : alors que « les approches de population générale ont de nombreuses limites identifiées avec les dépistages organisés au niveau national, dont une adhérence modérée, des effets collatéraux comme les faux positifs et les sur-diagnostics, une prévention et un dépistage personnalisés en fonction du risque individuel de cancer semblent aujourd’hui une voie d’avenir majeure ».
Génomique et thérapies ciblées en oncologie
De fait, c’est aujourd’hui en oncologie que la médecine personnalisée est le plus avancée en pratique : on considère que 70 % des molécules développées dans ce domaine sont des thérapies ciblées ou des médicaments dits de précision, c’est-à-dire calibrés pour cibles les caractéristiques génétiques et biochimiques de la tumeur.
On appelle thérapies ciblées les médicaments qui bloquent des mécanismes spécifiques des cellules cancéreuses. Leur essor est considérable : de quelques molécules il y a dix ans, plusieurs dizaines sont aujourd’hui disponibles et plusieurs centaines en développement. Certaines thérapies ciblées ont bouleversé le pronostic des patients (leucémie, cancer du sein, etc.).
Les thérapies ciblées sont, pour la plupart, basées sur des facteurs génétiques prédictifs de la réponse. Tout en étant plus efficaces, elles sont souvent mieux tolérées que les traitements conventionnels chimiothérapiques car respectant mieux les cellules saines. Pour les patients, pareil tournant thérapeutique incarne le plus bel espoir : des traitements à la fois plus efficaces et davantage compatibles avec leur qualité de vie, puisque moins lourds et mieux tolérés.
Il s’agit incontestablement de la voie pharmaceutique d’avenir en cancérologie. Son utilisation en routine dépend de l’implémentation des tests génomiques et de la diffusion des technologies de pointe qui séquencent un grand nombre de gènes associés à la maladie, connues sous le nom de tests de séquençage de nouvelle génération. Associées à d’autres démarches de diagnostic du cancer, tels que l’imagerie, ces informations génomiques complètes transforment la clinique du cancer. La capacité d’utiliser ces technologies suppose de traiter, de stocker, d’interpréter de grandes quantités de données génomiques générées. L’enjeu d’interopérabilité est crucial pour relier des ensembles de données génomiques vastes et complexes à d’autres ensembles de données diagnostiques et cliniques, condition essentielle pour que l’information guide effectivement la décision.
Une baisse drastique des coûts
Les acteurs soulignent unanimement que l’accélération de la médecine personnalisée a été rendue possible par la rapidité avec laquelle le coût des tests génomiques a chuté en seulement deux décennies.
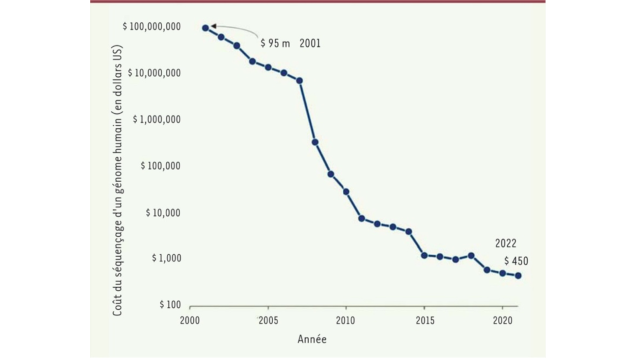
Source : Évolution du coût de séquençage, B.Jordan, Med Sci 2023 (Noter l’échelle logarithmique)
Le Human Genome Project, achevé en 2003 après 13 ans d’effort, a coûté environ 3 milliards de dollars. À partir de 2002, de nouvelles techniques reposant sur une combinaison de micromécanique, d’enzymologie sophistiquée et d’optique de précision permirent la lecture simultanée de millions de molécules d’ADN et autorisèrent une accélération considérable des travaux et un abaissement spectaculaire des coûts de séquençage. Parmi les acteurs de ce champ appelé Next-Generation Sequencing (NGS), la société Illumina, en position dominante sur le marché, affiche désormais un coût pour le séquençage d’un génome entier de l’ordre de 200 à 300 €. Comme le notait le biologiste Bertrand Jordan dans la revue Médecine/Sciences en 2023 : « On a là un bel exemple de progrès technique fulgurant, passant du génome à cent millions de dollars au génome à cent dollars en vingt ans seulement, comparable mais encore plus rapide que celui de l’informatique. (…) Soixante-dix ans après la découverte de la structure en double hélice de l’ADN et vingt ans après le premier séquençage d’un génome humain, l’accès aisé aux séquences de ces molécules n’a pas fini de transformer notre compréhension de la biologie ».
Le type de test qui peut être effectué évolue également : certains tests génomiques pour le cancer peuvent être réalisés à partir d’un échantillon de sang, connu sous le nom de biopsie liquide, plutôt qu’en prélevant du tissu cancéreux. Obtenue à partir d’une simple prise de sang, la recherche d’altérations génomiques du cancer par biopsie liquide est une méthode non-invasive. La biopsie liquide est particulièrement intéressante pour les patients dont les tumeurs sont difficilement accessibles ou dont l’état de santé ne permet pas une intervention invasive. Elle présente également un intérêt chez les patients atteints de cancers métastatiques en donnant une meilleure appréciation de l’hétérogénéité tumorale.
En France, l’institut Gustave-Roussy a ouvert depuis juillet 2024, en partenariat avec Roche, le laboratoire de biopsie liquide Fresh[5]. Avec une exclusivité Roche pour le test de profilage génomique, Gustave-Roussy se dote, ainsi que ses centres hospitaliers partenaires dans toute la France, d’une capacité d’analyse de 4 000 à 8 000 tests par an. « Une étape importante dans une approche personnalisée des traitements du cancer, note l’Institut, qui s’intègre pleinement dans les missions de l’IHU Prism, Centre national de médecine de précision ». A partir d’une prise de sang, les résultats du test de recherche des altérations génomiques tumorales (panel de 324 gènes) dans l’ADN circulant sont accompagnés de recommandations d’orientation thérapeutique personnalisées. L’ambition est de promouvoir un accès équitable des patients français aux médicaments anticancéreux innovants, en particulier dans des essais cliniques ouverts sur le territoire national au sein des centres hospitaliers publics et privés participant à l’initiative.
Quelle « personne » dans la personnalisation ?
L’un des traits que le narratif de la médecine personnalisée met le plus volontiers en avant, c’est que ce n’est plus l’état de maladie qui caractérise le patient de la médecine de demain : pris en charge dans une approche personnalisée, celui-ci fait l’objet d’une mesure ciblée de ses risques et, avant même d’être malade, pourra recevoir des soins précisément adaptés à son profil de risque. D’une démarche clinique réactive et curative, on passe donc à une vision dynamique de la santé et de ses anomalies. Une vision dynamique qui vient redéfinir les catégories fondamentales de la sémiologie médicale classique, définie comme la partie de la médecine qui traite des signes des maladies et fait essentiellement de l’activité clinique une méthode d’observation et d’interprétation des signes pathognomoniques d’un trouble précis. L’existence d’une frontière relativement étanche entre normal et pathologique en est, naturellement, l’arche conceptuelle fondamentale.
A rebours de cette démarche, la médecine personnalisée entend situer l’individu dans le continuum de vulnérabilités qui le caractérise : elle s’intéresse à la multitude d’infimes variations, en particulier génomiques, qui indiquent une probabilité de développer un phénotype particulier. Comprendre les bases génomiques de la variation phénotypique suppose de souscrire à une approche probabiliste de la santé et de la maladie. Car si certaines variations génétiques sont pathologiques, d’autres sont un facteur de risque, et pour beaucoup d’autres leur signification reste inconnue. La notion, centrale en médecine personnalisée, de facteurs prédictifs assume une part d’incertitude pour dire, non pas si l’état du patient est normal ou pathologique, mais où il se situe dans un gradient infiniment nuancé entre ces deux pôles.
La personne en médecine et la critique d’un soin « déshumanisé »
Mais que dit réellement ce gradient, horizon de potentiels, de la personne elle-même ? Est-ce à bon escient que cette médecine est dite « personnalisée » ? Et d’ailleurs, est-il raisonnable de juger que ce serait vraiment si révolutionnaire, pour la médecine, de vouloir offrir à chaque individu ce qui lui convient le mieux ? Si cette individualisation paraît tout de même être la logique naturelle, normale et ancienne de tout soin, en ce cas quelle portée donner à la démarche nouvelle de personnalisation ?
Dans un livre paru en 2016 et intitulé La médecine personnalisée, un essai philosophique, le philosophe Xavier Guchet, professeur à l’Université de technologie de Compiègne, interroge la polysémie du mot personne dans le concept de médecine personnalisée. Opposant, en citant Kant, la personne, définie par sa liberté, à la nature et à ses enchaînements réglés de causes à effets, Xavier Guchet juge que la personne ne peut se résumer à son génome, ses organes, ses caractéristiques biologiques : ces objets définissent un individu, et non une personne. En quoi, s’interroge-t-il, une médecine fondée sur la capacité technologique à acquérir, à stocker et à traiter des données massives est-elle « personnalisée » ?
Ce type d’interrogations nourrit une critique récurrente à l’encontre de la « médecine personnalisée », qui n’aurait de « personnalisé » que le nom, voire serait franchement impersonnelle. Xavier Guchet identifie une « tension entre une médecine ultratechnologique qui confère une signification moléculaire à la personne et une médecine du soin, centrée sur le patient ». En quoi, s’interroge-t-il, la médecine « personnalisée » se démarque-t-elle de « ce que les médecins font depuis toujours, à savoir adapter leurs diagnostics et leurs prescriptions à chaque patient » ? S’agit-il d’un nouveau paradigme médical, ou bien le terme récurrent de « révolution » fait-il office de signature marketing pour un marché pharmaceutique prometteur ? Le philosophe suggère qu’il n’y ait dans la médecine personnalisée qu’« une intensification de la médecine scientifique qui repose plus que jamais sur de l’impersonnel : des technologies de pointe, des algorithmes statistiques, des modèles informatiques ? Que devient le patient dans cette démarche qui intéresse avant tout les industriels et les autorités de santé ? »[6].
On retrouve ici une critique classique de la technicisation médicale, taxée de déshumaniser la personne. Karl Jaspers, notamment, l’a théorisée dans sa conférence de 1958 intitulée Le médecin à l’âge de la technique. Dans cet appel vibrant à retrouver « l’Idée de médecin », le philosophe allemand critique les « mirages » de la recherche et de la « technicisation » qui rompt, selon lui, avec ce que doit être le soin. Pour Jaspers, « un médecin doit traiter un malade qui est singulier, et dans le cadre du tout que constitue sa vie » ; dès 1958, il déplore donc qu’on puisse penser que « le malade moderne ne désire pas du tout être traité en tant que personne. Il se rendrait dans un hôpital comme dans un magasin, afin d’y bénéficier du meilleur service possible grâce à un appareillage impersonnel. (…) Le problème du médecin s’inscrit dans le cadre du processus global de la technicisation du monde ». La technique, ici, est dénoncée comme risquant de vider de son sens l’Idée de médecin.
Si l’on suit Jaspers, il faudrait aujourd’hui opposer aux prétentions de la médecine ultratechnique dite « personnalisée » la pratique plus humaine d’une médecine « centrée sur la personne ».
La professeure de bioéthique à Manchester Ruth Chadwick propose une analyse nuancée de la médecine personnalisée et de son rapport à la personne dans un papier de 2017 intitulé « What’s in a name »[7]. Souhaitant dépasser la dichotomie héritée de Jaspers, elle propose de distinguer plusieurs sens dans la personnalisation. Le premier sens est celui d’individualisation : l’adaptation du traitement à une personne unique. Si l’on retient ce sens, dit-elle, alors il n’y a pas vraiment lieu de parler de révolution paradigmatique : le jugement médical est toujours, et par définition, un jugement sur un cas.
Un deuxième sens possible, selon elle, repose sur l’idée de stratification : la médecine personnalisée repose sur la capacité nouvelle de classer les individus dans des groupes définis par leurs caractéristiques génétiques. Un troisième sens possible, sans doute souvent souhaité par les patients à qui l’on parle de médecine personnalisée, vise l’idée d’un soin qui traite le patient comme une personne, respecte son autonomie et sa volonté de définir ses préférences face à la maladie. Poussé un cran plus loin, ce sens donné à la personnalisation consisterait d’ailleurs même à respecter le patient non seulement comme personne mais même à traiter cette personne comme un tout : non pas seulement comme un cas individuel de fracture ou de tumeur, mais dans la globalité de son existence. Enfin, Ruth Chadwick identifie un quatrième sens possible pour la personnalisation en médecine : la personnalisation comme synonyme d’autosurveillance et de responsabilisation de la personne pour sa santé, au travers notamment des objets connectés qui obligent chacun à faire de sa santé un projet personnel et constant, mais aussi à devenir un producteur actif de « données personnelles » partagées.
Au terme de cette analyse sémantique, Ruth Chadwick propose de dépasser la question classique de savoir si la « personne » elle-même peut ou non être identifiée (réduite) à son patrimoine génétique ou à ses données. Elle souligne que la nouveauté du paradigme de la médecine personnalisée est qu’il s’intéresse non pas à ce que les personnes ont en commun (que ce soit leur condition d’être humain ou de malade, leur capacité générale d’autonomie ou bien leur condition clinique) mais, bien plus massivement, à la façon dont elles varient.
Selon cette interprétation, c’est la capacité de classer, de catégoriser ou de stratifier qui est centrale et source d’espoirs médicaux inédits dans la pratique de la médecine personnalisée – et non l’idée, trompeuse et trop souvent mise en avant, d’un « sur mesure » individuel. Ainsi, la philosophe considère que le concept central de cette approche réside dans la « stratification », et non la personnalisation : « En y regardant de plus près, l’information pharmacogénétique en elle-même ne permet qu’un faible sens de la personnalisation. Un test génétique peut permettre de classer un patient comme bon ou mauvais répondeur à un médicament particulier, comme métaboliseur lent ou rapide. Il serait sans doute plus juste de parler de stratification des patients ».
Dans un registre voisin, dans un papier paru en 2015 et intitulé « What Is Personalised Medicine? Sharpening a Vague Term Based on a Systematic Literature Review », le professeur de philosophie allemand Sebastien Schleidgen et son équipe proposent, sur le fondement d’une étude systématique de la littérature, de définir ainsi la médecine personnalisée : « La médecine personnalisée cherche à améliorer la stratification et la synchronisation des soins de santé en utilisant des informations biologiques et des biomarqueurs au niveau des voies moléculaires de la maladie, de la génétique, de la protéomique et de la métabolomique ». Le point intéressant est qu’ils retiennent dans cette définition la « stratification » plutôt que le « tailoring » souvent mobilisé dans les définitions. Les auteurs affirment que ce serait une erreur de donner l’impression que la médecine personnalisée concerne les personnes plutôt que la catégorisation des patients en groupes : la stratification est le terme le plus précis – et peut-être le plus honnête – en ce qui concerne les attentes des patients.
Enfin, le philosophe australien Peter Singer a critiqué lui aussi en 2005 dans un papier devenu classique la « médecine personnalisée de boutique »[8], visant les représentations que charrie l’opposition supposée entre un « sur mesure » moderne et l’archaïque « prêt à porter » thérapeutique.
C’est que la terminologie, pour tous ces auteurs, est loin d’être un point de détail. En témoigne la pente critique empruntée en France par certains professeurs de philosophie, qui sans hésiter vouent aux gémonies la technicisation « impersonnelle » d’un progrès thérapeutique pétri d’algorithmes et « déshumanisé ». Devant ces critiques, aussi caricaturales soient-elles, mieux vaut peut-être reconnaître avec Ruth Chadwick que la métaphore du « sur mesure » comporte des défauts éthiques sérieux, si elle suscite chez les patients des représentations personnelles que la médecine personnalisée n’a en fait pas vocation à combler.
[1] Sur ce sujet, voir André F « Changer de paradigme pour soigner les cancers : c’est maintenant, et c’est une question de justice », Terra Nova, 2022 https://tnova.fr/site/assets/files/44075/terra-nova_note_changer-de-paradigme-pour-soigner-les-cancers_251122.pdf?mbd29
André, F., Rassy, E., Marabelle, A., Michiels, S., & Besse, B. (2024). Forget lung, breast or prostate cancer: why tumour naming needs to change. Nature, 626(7997), 26–29.
[2] President’s Council of Advisors on Science and Technology, 2008, « Priorities for Personalized Medicine », The White House, p. 19
[3] Chen W, Wong NCB, Wang Y, Zemlyanska Y, Butani D, Virabhak S, Matchar DB, Prapinvanich T, Teerawattananon Y. Mapping the value for money of precision medicine: a systematic literature review and meta-analysis. Front Public Health. 2023 Nov 24;11:1151504. doi: 10.3389/fpubh.2023.1151504.
[4] Gaille M, & Horn R. The ethics of genomic medicine: redefining values and norms in the UK and France. European Journal of Human Genetics. 2021 29(5), 780–788.
[5] Audition de Michael Lukasiewicz, Directeur exécutif Science Roche France (Partenaire de Terra Nova)
[6] Guchet, X. (2016). La médecine personnalisée: un essai philosophique. Les Belles Lettres.
Guchet, X. (2014). Le patient « actionnable » de la médecine personnalisée. Socio-anthropologie, (29), 37–51.
[7] Chadwick, Ruth Felicity (2017). What’s in a name: conceptions of personalized medicine and their ethical implications. Lato Sensu: Revue de la Société de Philosophie des Sciences 4 (2):5–11
[8] Daar A., Singer P. Pharmacogenetics and geographical ancestry: Implications for drug development and global health. Nature Reviews Genetics. 2005; 6:241–246. doi: 10.1038/nrg1559