La recherche médicale en France, bilan et propositions
La recherche biomédicale est en recul en France. Moyens insuffisants, stratégie peu lisible, organisation complexe sous une administration trop lourde, perte de vocations… Quel que soit l’indicateur observé, pour la recherche scientifique en général et la recherche en santé en particulier, notre pays n’est pas au rendez-vous ; la part, par exemple, de la France dans les publications scientifiques mondiales a baissé de 34% entre 2005 et 2018. Le constat mérite attention, car les défis de la santé pour demain sont, plus que jamais avec la crise Covid, en haut des agendas politiques et sociétaux. Alain Fischer explore ici avec précision le diagnostic de ce qui dysfonctionne, pour bâtir un plan d’actions en douze propositions.


La recherche scientifique est un moteur de l’activité humaine et un élément de la souveraineté nationale.
Les avancées scientifiques dans de nombreux domaines, des mathématiques et de l’informatique à travers la révolution numérique jusqu’aux sciences humaines et sociales, y ouvrent de nombreuses opportunités. Spécifiquement, la recherche biomédicale et en santé, à laquelle le présent rapport est consacré, est le vecteur des progrès en santé. Malheureusement, malgré de brillantes exceptions, force est de constater que la recherche scientifique en France, et en particulier dans le domaine biomédical, est en recul, comme l’attestent de nombreux indicateurs. Les causes en sont connues : insuffisance de moyens, organisation complexe, administration lourde, stratégie peu lisible, monde hospitalo-universitaire en difficulté…
L’application de la loi pluriannuelle sur la recherche et le plan Santé 2030 constituent des tentatives de réponses mais qui ne paraissent à la hauteur des enjeux, ni sur le plan financier, ni sur les plans organisationnel et stratégique.
Si l’on admet que la recherche scientifique doit être prioritaire compte tenu des multiples enjeux sociétaux auxquels elle peut contribuer à apporter des réponses, il faut alors envisager un plan d’action qui marque fortement tant la communauté scientifique que nos concitoyens, notamment les plus jeunes qu’il faut pouvoir mieux attirer vers ses métiers. Ce plan devrait comporter une revalorisation progressive du financement de la recherche en s’inspirant de l’effort accompli par l’Allemagne au cours de ces vingt dernières années et ce, en gardant à l’esprit le caractère primordial de la recherche fondamentale. En parallèle, une série de mesures à visée de simplification telles qu’évoquées dans ce texte pourraient être mises en œuvre pour accroitre l’efficacité de notre système de recherche. Une réorganisation de la gouvernance des centres hospitalo-universitaires, associant réellement les partenaires universitaires et de recherche au partenaire hospitalier, devrait faire l’objet d’une réflexion attentive, en s’inspirant du succès du modèle développé aux Pays-Bas. Enfin, comme Robert Debré l’avait constaté dès 1970, un effort particulier devrait être consacré au développement de la recherche en santé publique dont la masse critique est aujourd’hui insuffisante. Une initiative forte et durable en faveur de la recherche scientifique aurait aussi le mérite de porter l’attention vers la science et, de ce fait, de contribuer à améliorer la culture scientifique et la capacité de jugement fondé sur la rationalité de nos concitoyens.
Points saillants
I. CONSTATS
- Affaiblissement progressif des performances de la recherche en France, notamment en sciences de la vie et en médecine/santé en comparaison avec les pays voisins.
- Financement insuffisant de la recherche en France malgré quelques efforts récents.
- Défaut d’attractivité des carrières de chercheurs (ainsi que de la formation par la recherche) du fait de salaires médiocres, de moyens de recherche souvent insuffisants et d’une complexité organisationnelle et administrative.
- Absence de vision stratégique d’ensemble de la recherche biomédicale dont le financement est émietté, pas toujours bien évalué et objet parfois d’effets d’aubaine.
- Part excessive du financement des équipes par projet plutôt que par dotations, ce qui fragilise la vie et la structure des équipes.
- Stagnation de la recherche privée, place insuffisante des chercheurs dans la définition de la stratégie des entreprises.
II. PROPOSITIONS
- Nécessité d’une revalorisation progressive mais substantielle du financement de la recherche, notamment en sciences de la vie en s’inspirant de la démarche allemande au cours de ces vingt dernières années. Réorienter une partie du crédit impôt recherche. Cet effort est indispensable pour attirer de jeunes chercheurs, constituer et renforcer le « tissu » de recherche du pays. Il faut éviter deux écueils : le saupoudrage et la concentration excessive des moyens autour d’un nombre trop restreint de chercheurs et d’instituts.
- L’effort financier doit concerner en premier lieu les salaires à tous les stades de la carrière des acteurs de la recherche y compris les acteurs de la recherche clinique, mais aussi les équipements, les infrastructures et les crédits de fonctionnement des équipes de recherche.
- Un effort de rééquilibrage au bénéfice du financement récurrent par dotation paraît nécessaire sous condition de la prise en considération effective de l’évaluation des équipes de recherche.
- Évaluer mieux les équipes, moins souvent, et en tirer les conséquences. Simplifier et limiter la fréquence des évaluations des chercheurs et de leurs équipes. Cette évaluation doit suivre scrupuleusement les principes de la déclaration dite de DORA et les recommandations du COARA qui privilégient l’évaluation qualitative par rapport à l’évaluation quantitative.
- Simplifier l’organisation des agences et opérateurs de la recherche. Pour la recherche biomédicale, confier à l’Inserm la responsabilité des agences thématiques et du programme hospitalier de recherche clinique (PHRC) afin de lui donner les moyens d’élaborer et de mettre en œuvre une vision stratégique globale de la recherche biomédicale et d’en assurer une bien meilleure efficacité.
- Envisager une transformation de la structure du financement de la recherche en confiant aux EPST et aux EPIC non seulement l’attribution des dotations récurrentes aux équipes mais aussi le financement par projet dans leur champ respectif. Les capacités stratégiques des établissements seraient ainsi renforcées alors que l’organisation serait simplifiée : le financement de la recherche reposerait sur deux piliers, (universités d’une part, EPST/EPIC), au lieu de trois actuellement (universités, EPST/EPIC et ANR). Les alternatives consistant à conserver universités et ANR en supprimant les EPST, ou à conserver EPST et ANR en excluant les universités ne sont ni réalistes ni souhaitables.
- Réformer l’organisation des CHU en rapprochant autant que possible les institutions en charge des trois missions principales (soins, enseignement et recherche), expérimenter en s’inspirant du modèle néerlandais.
- Développer des instituts de recherche (modèle IHU) sur site au sein des CHU à chaque fois que possible en s’appuyant sur une solide évaluation a posteriori par les tutelles. D’une manière plus générale, élaborer une stratégie de site en s’appuyant sur les compétences et spécificités régionales.
- Mettre en place un plan de développement de la recherche et de l’enseignement en santé publique au sein des facultés de santé mais aussi en UFR de sciences humaines et sociales et au sein des EPST. Mettre l’accent sur la question des inégalités socio-culturelles, sources majeures des inégalités en santé.
- Renforcer l’emploi des docteurs dans les entreprises, poursuivre les actions de facilitation de l’innovation en santé.
- Faciliter les transferts de la recherche fondamentale aux acteurs de la recherche opérationnelle, à la logistique et aux agences de régulation et d’autorisation des produits de santé.
- Développer la culture scientifique à tous les âges de la vie, favoriser et réguler l’intervention des scientifiques dans les médias. Renforcer la place des experts scientifiques auprès des décideurs tant dans le monde industriel que politique.
Glossaire
- ANR : Agence Nationale de la Recherche
- ANRS : Agence Nationale de Recherche sur le SIDA et les hépatites virales
- ARC : Association pour la Recherche sur le Cancer
- CHU : Centre Hospitalo Universitaire
- CIR : Crédit Impôt Recherche
- CNAM : Caisse Nationale d’Assurance Maladie
- CNRS : Centre National de Recherche Scientifique
- COARA : COalition for Advancing Research Assessment
- CSIS : Conseil Stratégique des Industries de Santé
- DORA : Declaration On Research Assessment
- DIRDE : Dépenses Intérieures de Recherche & Développement par les Entreprises
- DRCI : Direction de la Recherche Clinique et de l’Innovation
- EPIC : Établissement Public à caractère Industriel et Commercial
- EPST : Établissement Public à caractère Scientifique et Technologique
- ERC : European Research Council
- FRM : Fondation pour la Recherche Médicale
- GIS IBiSA : Groupement d’Intérêt Scientifique – Infrastructures en Biologie Santé et Agronomie
- HCERES : Haut Conseil de l’Évaluation de la Recherche et de l’Enseignement Supérieur
- HERA : Health Emergency Preparedness and Response Authority
- IHU : Institut Hospitalo Universitaire
- INCa : Institut National du Cancer
- INSERM : Institut National de la Santé et de la Recherche Médicale
- ITA : Ingénieurs, Techniciens, Administratifs
- LPR : Loi de Programmation de la Recherche
- MCU : Maitre de Conférence des Universités
- MERRI : Missions d’Enseignement, de Recherche, de Référence et d’Innovation
- MIGAC : Missions d’Intérêt Général et d’Aides à la Contractualisation
- MIRES : Mission Interministérielle Recherche et Enseignement Supérieur
- MRC : Medical Research Council
- OPECST : Office Parlementaire d’Évaluation des Choix Scientifiques et Technologiques
- PHRC : Programme Hospitalier de Recherche Clinique
- PIA : Plan Investissement Avenir
- PUPH : Professeur des Universités Praticien Hospitalier
- SATT : Sociétés d’Accélération du Transfert de Technologies
- SIGAPS : Système d’Interrogation, de Gestion et d’Analyse des Publications Scientifiques
- UFR : Unité de Formation et de Recherche
- URC : Unité de Recherche Clinique
Introduction
La science fait partie intrinsèque de la culture. L’homme a toujours cherché à mieux connaitre les lois de la nature, et les acquis scientifiques font partie de notre patrimoine commun. La recherche scientifique est donc une activité sociale et culturelle d’intérêt majeur. Bien utilisées, les avancées des connaissances sont source de progrès collectifs.
Les connaissances issues de la recherche scientifique constituent une composante essentielle de la réponse aux défis de la transition écologique et de la transition numérique. La recherche en biologie-santé sous-tend les progrès de la médecine. Les avancées des dernières décennies ont contribué à une amélioration de l’état de santé de la population qui se traduit par une augmentation régulière de l’espérance de vie, y compris de l’espérance de vie en bonne santé(i,ii), même si cela engendre mécaniquement une augmentation du nombre de personnes, plutôt âgées, souffrant de pathologies chroniques. Traitement des cancers, prévention et traitement des maladies cardiovasculaires, meilleure prise en charge des maladies inflammatoires, rhumatismales et auto-immunes, succès de l’antibiothérapie et des vaccinations sont autant d’exemples de traductions concrètes de la recherche scientifique en progrès en santé.
Néanmoins, les enjeux scientifiques et sociétaux sont de taille : que l’on pense aux maladies mentales, domaine qui souffre d’un déficit de recherche, aux échecs encore trop fréquents du traitement des cancers, à la plupart des maladies génétiques pour lesquelles il n’existe pas de traitement, aux maladies liées à des déterminants environnementaux (infections émergentes, antibiorésistance, obésité, effet des substances polluantes, addictions, iatrogénie liée à la surmédicalisation, conséquences du réchauffement climatique…), nombreuses sont les questions de santé non ou mal résolues. S’y ajoutent les problématiques d’accès de tous aux progrès de la médecine et de compréhension de ces enjeux par l’ensemble des citoyens.
Parce qu’elle nourrit les innovations, la recherche est un facteur déterminant de la croissance économique et de la création d’emplois. Les chercheurs contribuent à la reconnaissance internationale de notre pays. A ce triple titre – faire progresser les connaissances, améliorer le bien-être social et promouvoir l’activité économique –, la recherche scientifique est une activité qui justifie la pleine attention du monde politique.
Dimensions de la recherche en biologie et en santé Lorsque l’on parle de recherche biomédicale et en santé, il convient d’en définir au mieux le champ disciplinaire qui peut schématiquement se décliner en quatre dimensions :
Cette classification définit le champ de la recherche biomédicale, mais elle ne doit surtout pas donner l’illusion d’une séparation de ces quatre domaines. Ceux-ci doivent à chaque fois que possible être intégrés ou du moins, il importe de faire en sorte que les échanges d’informations entre eux soient continus et fluides. Ce point conditionne l’organisation de la recherche biomédicale et en pratique la nécessité de disposer d’instituts de recherche capables de maitriser plusieurs de ces dimensions. Nous y reviendrons dans les sections 3 et 4. |
Le thème de ce document concerne plus spécifiquement la recherche biomédicale, donc largement (mais bien sûr non exclusivement) les recherches en sciences de la vie. Il aborde néanmoins une série de questions comme celles du financement de la recherche ou de son attractivité qui sont communes à l’ensemble de la recherche scientifique. Ce document est construit en deux parties : la première (sections 1 et 2) présente un état des lieux de la recherche et ce qui nous parait caractériser un recul de la France dans ses performances en particulier dans le domaine biomédical en corrélation avec un financement stagnant ; la seconde (section 3) trace des pistes de propositions pour redonner une meilleure place à cette recherche.
Outre les enjeux culturels et sociétaux évoqués plus haut, l’impact des révolutions scientifiques et technologiques récentes dans leurs applications médicales doit être pris en compte : bases de données de cohortes de patients « intelligentes », analyse multimodale, émergence de nouvelles thérapeutiques d’origine biologique (protéines, ARN, ADN), développement de dispositifs médicaux et objets connectés de télémédecine.
1. Un affaiblissement progressif de la recherche française
Le décrochage de la France dans les domaines de la biologie et de la santé
Ce constat a été fait dans de nombreux rapports récents, dont ceux de l’Académie des sciences(iii) et de l’Académie nationale de médecine(iv).
1.1. Une production scientifique en baisse de performance
La position scientifique de la France dans le monde
Part des publications scientifiques mondiales
La France représente 2,8% des publications scientifiques internationales tous domaines confondus et se place derrière le Royaume-Uni (3e position, 4,5 %), l’Allemagne (4e position, 4,3 %), ou encore l’Italie (7e position, 3,0 %)(v). Malgré un volume de publication croissant, la part de la France dans les publications scientifiques mondiales a baissé de 34% (passage du rang 6 au rang 9) entre 2005 et 2018. Il s’agit du deuxième plus fort recul parmi les 12 premiers pays, derrière le Japon.
Figure 1. Part mondiale des publications scientifiques des 12 premiers pays, 2005–2018 (%)
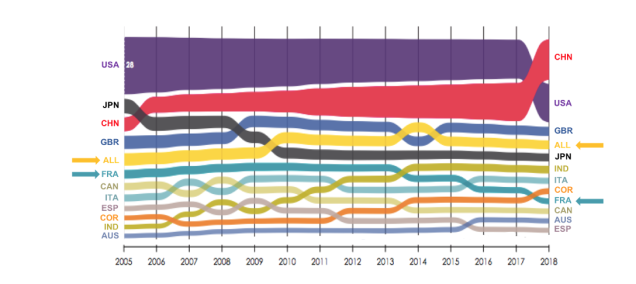
Source : OST (2021), La position scientifique de la France dans le monde et en Europe, 2005–2018, Hcéres
Publications scientifiques à fort impact
La France se situe à la 6e place du classement effectué par la revue Nature (indicateur fondé sur la contribution aux articles publiés dans 82 journaux suivis par Nature Index), derrière l’Allemagne (3e) et le Royaume-Uni (4e)(vi). Rapporté au nombre d’habitants, cet indicateur place la Suisse, les Pays-Bas mais aussi la Suède largement devant la France. La France est le pays enregistrant le plus fort déclin sur la moyenne des 5 dernières années parmi les 10 premiers pays du classement.
Les publications à fort impact en recherche biologique et médicale ont vu leur part augmenter dans la production nationale, mais le travail d’évaluation de la position scientifique de la France par l’Observatoire des Sciences et Techniques révèle que l’indice d’impact des publications de la France dans ces domaines reste autour de la moyenne mondiale (entre 0,8 et 1,1), soit en-dessous des résultats des recherches provenant des pays anglo-saxons, d’Allemagne, de Scandinavie, de Suisse et des Pays-Bas.
Brevets
Avec 6% des demandes enregistrées par l’Office Européen des Brevets, la France se place au 5e rang mondial, derrière l’Allemagne (14%) mais devant le Royaume-Uni (3%)(vii).
Dans le domaine des produits pharmaceutiques et des technologies médicales, la France occupe respectivement la 4e et 6e place avec 5% des demandes enregistrées.
Classement des universités
Parmi les 100 premières universités primées par le classement annuel mondial Quacquarelli Symonds (QS), on compte 17 universités britanniques, 4 universités françaises et 3 universités allemandes.
Dans le domaine de la santé, le classement international par l’université Jiao Tong (Shanghai) des universités médicales retient lui aussi seulement 4 universités françaises parmi les 100 premières, contre 17 universités britanniques, 6 universités néerlandaises et 5 universités allemandes.
Récompenses scientifiques et contrats de recherche
Parmi les lauréats du prix Louis-Jeantet pour la médecine, une prestigieuse récompense européenne dans le domaine de la recherche biomédicale, la part de Français diminue : 7 chercheurs français l’ont reçu entre 1986 (année de création du prix) et 1998, contre 5 entre 1999 et 2010, et seulement 3 entre 2011 et 2022(viii).
Les contrats de l’European Research council (ERC) représentent un bon marqueur de la qualité de la recherche d’un pays européen puisqu’ils font l’objet chaque année d’une évaluation comparative soigneuse fondée sur la qualité des chercheurs et de leurs projets, et ce, en toute indépendance à l’égard du pays d’origine. Toutes les disciplines scientifiques sont concernées, sans priorité thématique. La figure 2 ci-dessous compare les performances de la France et l’Allemagne au cours du temps dans 2 champs disciplinaires : MIPC (mathématiques / informatique / physique / chimie) et SDV (sciences de la vie – dont médecine). Le paramètre retenu est le ratio du nombre de contrats ERC obtenus en France et en Allemagne en fonction du temps dans ces deux champs disciplinaires. Tous les types de contrats ERC sont inclus. Une étude plus détaillée par type de contrat (« advanced », « consolidator » ou « starting ») donne des résultats similaires. Le ratio de population entre la France et de l’Allemagne est de 0,81 (ligne pointillée), toute valeur supérieure à 0,81 indique donc une meilleure performance française et réciproquement. Il apparait qu’il y a 15 ans les chercheurs français obtenaient plus de contrats ERC que leurs homologues allemands et ce, dans toutes les disciplines. On observe ensuite une décroissance globale du ratio et une inversion indiquant de meilleures performances des chercheurs allemands en SDV. Il est remarquable d’observer que ces courbes sont corrélées avec l’évolution des budgets dévolus à la recherche par ces deux pays (cf. Figure 3). D’autres comparaisons avec « les petits pays » comme les Pays-Bas, la Suède ou la Suisse ne sont pas non plus favorables à la France. Il en est de même de la comparaison avec le Royaume-Uni (jusqu’à 2020 puisque les Britanniques n’ont plus accès à l’ERC depuis le Brexit).
Figure 2. Contrats de l’European Research Council (ERC) obtenus, ratio France / Allemagne

Source : erc.europa.eu/projects-statistics
Recherche française et pandémie de Covid-19(ix) La crise pandémique de Covid-19 a mis en lumière le manque de préparation, d’anticipation et de priorité accordées par la France à la lutte contre les maladies infectieuses émergentes. Notre pays avait pourtant démontré, s’agissant de la lutte contre le sida, à partir de 1988, sa capacité à structurer une communauté de chercheurs et à maintenir un haut niveau de financement aux études et essais concernant le VIH, avec l’aide déterminante des associations de patients. La France n’a pas su construire la même mobilisation autour de la lutte contre les maladies infectieuses émergentes. De fait, elle n’a pas été en mesure de produire rapidement un vaccin ou une prophylaxie médicamenteuse contre la Covid-19 même s’il faut noter des contributions de qualité dans les domaines de l’épidémiologie et de la physiopathologie de l’infection à SARS-CoV-2 avec le soutien du consortium public Reacting. On peut regretter l’absence de coopération entre le monde académique et les entreprises pharmaceutiques. Au cours des vingt dernières années, plusieurs épisodes épidémiques ont constitué des signaux d’alerte (Zika, Ebola, H1N1, SARS-CoV-1, etc.). Pourtant, ces évènements n’ont pas entraîné de mouvement de structuration ou de définition d’une stratégie particulière de la part des pouvoirs publics en ce qui concerne les maladies émergentes, notamment liées au coronavirus. Des sommes conséquentes ont certes été accordées via les programmes d’investissements d’avenir (PIA) à certaines structures, mais ces diverses mesures ont été prises en l’absence de vision d’ensemble et sans souci prospectif. Cette situation contraste avec celle de la recherche allemande qui a permis l’élaboration très rapide des premiers tests diagnostiques et a contribué à la mise au point des vaccins à ARN. On ne peut s’empêcher de mettre en parallèle ces résultats avec l’augmentation très sensible des fonds alloués à la recherche scientifique en Allemagne et de leurs méthodes d’allocation au cours des mandats Merkel. L’Allemagne a sans doute pu ainsi renforcer la densité de ses laboratoires de recherche. Il n’est pas sûr que Christian Drosten, virologue à Berlin, aurait pu, s’il avait été en France, mettre très vite au point des tests diagnostiques, faute de soutien à un laboratoire travaillant sur les coronavirus avant la pandémie. Il n’y avait en effet plus de laboratoires consacrés à ces virus en France en 2019, faute de financement. De même le fait que les chercheurs Ugur Sahin et Ozlem Tureci, fondateurs de BioNTech, disposaient d’un laboratoire au sein d’un institut public « Fraunhofer » à Manheim, leur a donné les bases académiques du développement du vaccin distribué ensuite par Pfizer. En aurait-il été de même en France ? |
Peu importe le critère retenu, la France se place derrière le Royaume-Uni et l’Allemagne en matière de recherche en biologie-santé. S’il est vrai qu’aucun de ces critères évalués individuellement ne suffirait à poser un diagnostic, en revanche il paraît difficile de nier la convergence des constats qu’ils permettent : celui d’un affaiblissement de la France en matière de recherche en biologie-santé.
1.2. Un financement inférieur à la plupart des pays développés
Données budgétaires publiques et privées
En France en 2020, 54,2Md€ ont été investis pour financer les activités de recherche et développement (R&D). Cela représente 2,21% du PIB (données MESRI 2020). Cette performance est inférieure aux 3% visés par la stratégie de Lisbonne[1], objectif par ailleurs atteint par l’Allemagne (3,04%), cf. Figure 3. La part du PIB investie en crédits publics dans la dépense intérieure de R&D était de 0,73% en 2018(x), ce qui place le pays au 10e rang de l’UE, derrière l’Allemagne notamment (0,98%). Depuis, on observe en France un léger accroissement des crédits publics (26,2 Md€ en 2016, 28,1 en 2019, 29,2 en 2022, 30,8 prévus en 2023 mais dans un contexte d’inflation et de surcoût de l’énergie).
Dans le secteur de la biologie-santé, les 15 dernières années ont vu une chute des crédits publics de R&D en France (cf. Figure 4): une baisse de 28% est enregistrée entre 2011 et 2018, alors que les crédits publics investis dans la recherche en biologie-santé ont augmenté significativement en Allemagne (+11%) et au Royaume-Uni (+16%)(v, xi). Ainsi, en France en 2020, la part du budget affectée à la santé et aux sciences biologiques n’était plus que de 17,2%, contre 20% en 2005(xii) (cf. Figure 5). Cette part investie dans la recherche en biologie-santé est faible comparée aux pays voisins, pour lesquels elle représente environ 30% (jusqu’à 50% au Royaume-Uni).
Figure 3. Dépenses intérieures de R&D en % du PIB (1996–2020)

Source: World Bank, 2021
Figure 4. Investissements publics en recherche biomédicale (milliards de $)
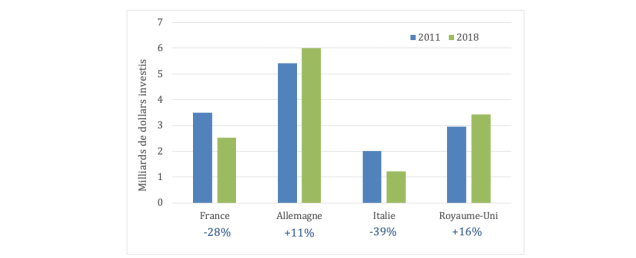
Source : Organisation for economic cooperation and development budget allocations for R&D
Infrastructures et équipements
Le développement et l’utilisation d’équipements et d’infrastructures régulièrement renouvelés et conformes aux standards internationaux sont à la base des grandes découvertes scientifiques. Ils constituent un élément essentiel de l’efficacité et de l’attractivité de la recherche d’un pays. Outre les équipements et infrastructures de pointe indispensables pour l’exploration de la matière dans les domaines de la physique, de la chimie, des sciences de la terre et des sciences de la vie, les besoins de plateformes liés à l’essor du numérique, au calcul, à l’utilisation des grandes masses de données et à l’ouverture des données de la recherche concernent tous les domaines scientifiques. Il est donc indispensable d’investir pour porter et maintenir les équipements et infrastructures de recherche au meilleur niveau international. Il faut souligner l’absence historique (depuis la disparition de la société CGR[2]) de la France dans le développement de grands équipements de recherche en santé en particulier dans les domaines de l’imagerie médicale.
Les infrastructures de recherche constituent un atout essentiel de notre pays dans certaines disciplines, en particulier en physique et en sciences de la terre et de l’univers où la France est historiquement très investie, souvent avec ses partenaires européens (CERN, observatoires, spatial, etc.). L’investissement est bien moindre en biologie-santé.
Certes, l’État a beaucoup investi, à travers le premier Programme des investissements d’avenir (PIA), dans des équipements d’envergure pour la recherche en biologie-santé comme par exemple le laboratoire P4[3] à Lyon, qui permet aux scientifiques de travailler sur les virus les plus dangereux. Il n’existe toutefois pas en France de mécanisme de financement pérenne des infrastructures de recherche en biologie-santé, contrairement à d’autres pays[4]. La création en 2007 du groupement d’intérêt scientifique Infrastructures en Biologie Santé et Économie (GIS IBiSA) avait vocation à remplir ce rôle. Son budget a néanmoins chuté de 15 M€ en 2008 à 2,5 M€ en 2021. La forte dépendance aux financements du PIA d’infrastructures correspondant à des besoins pérennes pose la question du financement de leur entretien qui nécessite de nouveaux fonds du PIA pour continuer à fonctionner.
La recherche en sciences de la vie a ainsi été bouleversée par les progrès en matière d’imagerie, en particulier avec l’apparition des cryo-microscopes électroniques. La France n’en possède que quatre. À titre de comparaison, les universités et centres de recherche allemands en possédaient 39 en 2020. Ces microscopes étaient au nombre d’une vingtaine au Royaume-Uni.
A la faveur d’une prise de conscience accélérée par la crise du Covid-19, l’enjeu a été reconnu au travers des investissements annoncés par le Président de la République, en juin dernier, en conclusion des travaux du Conseil stratégique des industriels de santé (CSIS)[5]. Le Plan Innovation santé 2030 comporte une volonté affichée de renforcer les infrastructures de recherche, mais, comme on le verra plus loin, sa construction pose question au regard des besoins réels.
1.3. Effectifs des métiers de la recherche
L’emploi affecté à la recherche en France s’établit à environ 450 000 ETP (équivalents temps plein, chiffres 2018), en hausse de 1,6% en moyenne annuelle sur 10 ans. A noter que cette croissance est entièrement portée par les entreprises, tandis que l’emploi scientifique stagne dans les EPST et les principaux EPIC(xiii). Parmi les 650 000 personnes qui participent à l’activité de R&D en France, deux tiers sont des chercheurs. Avec 150 000 personnels de soutien à la recherche (non-chercheurs qui participent à l’exécution des projets de R&D : techniciens, personnels de bureau et de secrétariat administratifs), le ratio « personnel de soutien pour un chercheur » diminue régulièrement et atteint 0,47 en 2019 contre 0,59 en 2012.
Les chercheurs sont répartis à 60% en entreprise – leur part a progressé de 5 points en 10 ans – et 40% dans le secteur public(xiv). Ce taux est proche de celui de l’Allemagne et des Pays-Bas (60% et 63% de chercheurs dans le privé), alors que la tendance est plutôt inversée en Espagne, au Royaume-Uni et en Italie (37%, 38%, 43%, respectivement).
Au sein de l’Union européenne, la France est le deuxième pays en termes de nombre de chercheurs (300.000 ETP), précédée par l’Allemagne (420.000 ETP) et suivie par le Royaume-Uni (290.000 ETP)(xiii). La densité de chercheurs dans la population française s’élève à 10 pour 1000, devant l’Allemagne et le Royaume-Uni. Des pays moins peuplés comme le Danemark, la Suède, ou encore la Belgique disposent néanmoins d’une densité supérieure de professionnels de la recherche.
La France occupe une position satisfaisante concernant la stabilité de l’emploi des chercheurs, puisque 9 chercheurs sur 10 sont en CDI ou fonctionnaires. C’est plus qu’en Italie (8 sur 10) ou en Allemagne (6 sur 10), et à peine moins qu’au Royaume-Uni. Cependant, cette stabilité est nuancée par un début de carrière en emploi stable toujours plus tardif : 32 ans pour les chargés de recherche, 34 ans pour les maitres de conférences des universités, en recul de 2 ans par rapport à 10 ans plus tôt.
Du point de vue des effectifs de chercheurs, la France n’accuse donc pas de déficit comparé à ses voisins européens. Des résultats inférieurs en termes de production scientifique en biologie-santé laissent alors supposer une moindre efficience.
2. Les causes de ce retard
2.1 Faible attractivité des carrières de recherche
Les salaires des métiers de la recherche sont modestes, de la thèse aux directeurs de recherche et professeurs des universités. Il en est de même pour les ingénieurs et techniciens[6] (ITA) (cf. tables 1 et 2 ci-après). Les salaires de début de carrière semblent inappropriés au vu du nombre d’années d’études et des concours à passer pour accéder à un poste de chargé de recherche, et au regard aussi des lourdes taches d’enseignement des MCU. Les meilleurs étudiants se détournent de plus en plus de la recherche, et s’orientent après le baccalauréat majoritairement vers les écoles d’ingénieurs qui ne dirigent que peu d’entre eux (hors exceptions brillantes) vers une formation à et par la recherche. Cela est d’autant plus regrettable qu’il existe en France une bonne tradition de formation scientifique dans l’enseignement supérieur universitaire. Il faut aussi noter une certaine perte d’attractivité à l’égard des étudiants étrangers originaires de pays francophones qui plus souvent qu’autrefois vont se former dans les autres pays d’Europe, les États-Unis ou le Canada.
Table 1. Salaires bruts mensuels des personnels titulaires à temps complet des EPST selon le corps en 2020
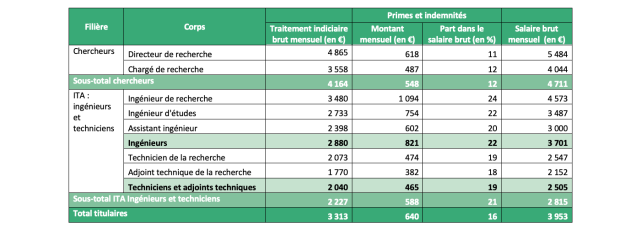
Source : Ministère de l’Enseignement Supérieur, de la Recherche et de l’Innovation
Table 2. Rémunération (traitement brut et certaines primes) des chargés de recherche, maitres de conférences, directeurs de recherche et professeurs des universités en 2021
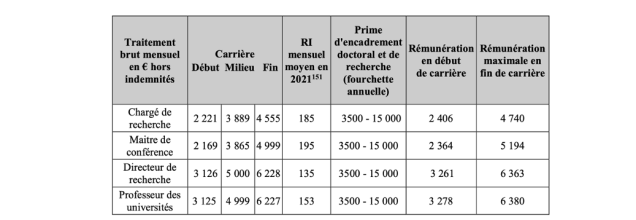
Source : Cour des comptes
La rémunération d’un chercheur ou enseignant-chercheur français dans le secteur public est composée de la rémunération indiciaire et d’une rémunération indemnitaire. La rémunération indiciaire s’élève, pour un chargé de recherche ou un maître de conférence (soit le 1er grade des corps des organismes de recherche et des universités), autour de 2.200 € brut en début de carrière et entre 4.500 € et 5.000 € en fin de carrière, et à environ 3.120 € en début de carrière pour les directeurs de recherche et professeurs d’universités et 6.230 € en fin de carrière. À ce traitement indiciaire s’ajoute une prime de recherche (pour le corps des chercheurs) ou une prime de recherche et d’enseignement supérieur (pour le corps des enseignants chercheurs) d’un montant compris entre 135 € et 195 € par mois. Enfin, certains chercheurs ou enseignants chercheurs peuvent bénéficier d’une prime d’encadrement doctoral et de recherche d’un montant compris entre 3.500 € et 15.000 € annuel. Contrairement à la prime de recherche, elle n’est pas automatique. Elle ne bénéficie qu’à 25 % des chercheurs et enseignants chercheurs, pour un montant annuel moyen de 4 840 € par personne. Pour l’Inserm, environ 25 % des chercheurs en bénéficiaient en 2020, pour un montant annuel moyen de 3.847 €. Or, c’est la faiblesse de ces primes dans la recherche qui contribue au différentiel de rémunération existant entre les chercheurs et le reste de la fonction publique de catégorie « A », dévalorisation financière comparative qui contribue à un défaut d’attractivité des métiers de la recherche[7]. |
Rémunération des chercheurs (comparaison France, Royaume-Uni, Allemagne)
La comparaison des salaires des chercheurs français avec ceux pratiqués en Allemagne ou au Royaume-Uni indique que les rémunérations sont sensiblement moins élevées en France en début de carrière. Ainsi, alors qu’un maître de conférence ou un chargé de recherche bénéficie d’environ 2.000 € nets mensuels en début de carrière, son homologue anglais (senior lecturer) bénéficie de 2.600 € net (cf. table 3). En fin de carrière, la rémunération maximale d’un professeur britannique demeure supérieure à celle d’un professeur d’université ou de directeur de recherche au dernier échelon français. En outre, il existe en Allemagne et au Royaume-Uni des dispositifs de chaires pour attirer les chercheurs les plus talentueux en leur offrant des moyens humains et matériels significatifs.
Table 3. Comparaison de rémunération France/Royaume-Uni
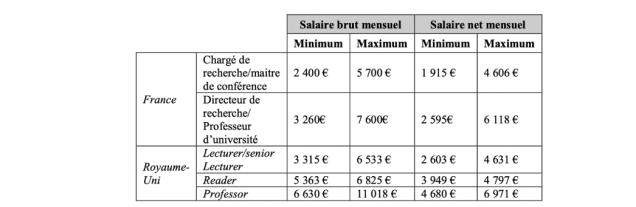
Source : Cour des comptes à partir des données de l’ambassade de France au Royaume-Uni
La comparaison des rémunérations avec les chercheurs allemands s’avère plus difficile, compte tenu de la part variable de la rémunération des professeurs, qui peut modifier substantiellement les rémunérations maximales. Toutefois, les rémunérations en début de carrière s’avèrent supérieures aux rémunérations en France (au minimum 4.000 € brut), comme l’indique la table 4 suivante.
Table 4. Comparaison de rémunération France/Allemagne
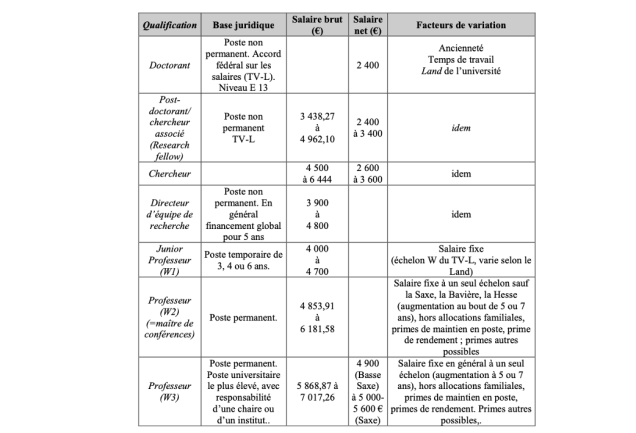
Source : Cour des comptes à partir des données de l’ambassade de France en Allemagne
L’Allemagne et le Royaume-Uni proposent, à côté de la rémunération, des moyens importants pour attirer les meilleurs chercheurs. En Allemagne, le principal programme, financé par le gouvernement fédéral permet chaque année d’octroyer à un chercheur étranger ou allemand travaillant à l’étranger la création d’une chaire dans une université allemande et dont le montant s’élève en général à 5 M€ pour des chercheurs en sciences expérimentales et à 3,5 M€ en sciences théoriques pour cinq ans. Jusqu’à présent, 80 chercheurs ont été attirés en Allemagne par cette voie.
Doivent être aussi réexaminés les conditions de travail et les salaires des personnes travaillant en recherche clinique (ingénieurs, assistants de recherche, techniciens de recherche clinique).
2.2. Financement déclinant de la recherche en sciences de la vie
Si les financements sont insuffisants dans de nombreux domaines de recherche en France, la biologie-santé nécessite une attention particulière(iv). La baisse de la part de la biologie-santé dans les financements publics attribués à la recherche (cf. Figure 5) se traduit par des difficultés à financer les infrastructures, les équipements et plateformes technologiques, les cohortes, les collections d’échantillons biologiques… et impacte l’ensemble des quatre domaines de la recherche en santé. Elle se traduit ainsi par l’absence de données cliniques et génétiques disponibles à large échelle sur le modèle britannique (UK biobank) et de l’insuffisance de développement de recherche sur les approches numériques.
Figure 5. Part du budget de la MIRES consacré à la biologie-santé (%)
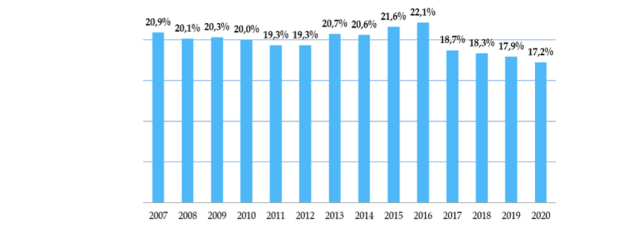
Source : MIRES, 2020
2.3. Un système fragmenté et complexe
Le fonctionnement de la recherche publique en France est fondé sur un système en mille-feuilles dont la complexité atteint son paroxysme en biologie-santé. Chaque équipe de recherche est affiliée simultanément à un Établissement Public à caractère Scientifique et Technologique (EPST) (ou à un Établissement Public à caractère Industriel et Commercial – EPIC) ainsi qu’à une université et/ou un hôpital. Les fonds nécessaires au fonctionnement des équipes de recherche ne sont obtenus que partiellement à travers des dotations modestes de l’Inserm[8] ou du CNRS[9] ou des autres établissements, ainsi que de l’université de rattachement, ou parfois des régions. Chaque équipe fait donc face à la nécessité de chercher des fonds auprès de l’Agence Nationale de la Recherche (ANR) et d’une multitude d’agences et de fondations thématiques (INCa, ANRS) sans parler de la recherche de financements caritatifs (FRM, ARC, Ligue nationale contre le cancer, AFM…).
Cet émiettement des sources de financement implique, pour l’équipe, une dépense importante de temps et d’énergie dans la préparation des dossiers, autant de ressources qui sont diverties du travail de recherche proprement dit. A titre de comparaison, au Royaume-Uni, les équipes de recherche sont soutenues par une université forte et obtiennent un financement par le Medical Research Council (MRC) ou par une institution privée, le Wellcome Trust (sans équivalent en France).
Par ailleurs, la valorisation industrielle des résultats de la recherche en biologie-santé est peu efficace, en reflet de ce système en mille-feuilles et de la fragmentation des opérateurs de la valorisation. Un trop grand nombre de structures se retrouve en compétition : entités au sein des CHU, des universités, de l’Inserm et du CNRS, auxquelles s’ajoutent les SATT, sociétés d’accélération du transfert des technologies, créées par le PIA dans un objectif de « simplification » du système. S’y ajoutent les entités destinées à l’innovation comme les instituts Carnot, les pôles de compétitivité…
Finalement, cette complexité se reflète également au niveau de l’organisation administrative dans la mesure ou chaque entité partie prenante dispose de son administration qui fonctionne avec ses règles propres.
Les agences spécialisées Avec l’épidémie de VIH, un modèle d’agence de recherche spécialisée s’est imposé autour de la création de l’ANRS en 1988. Par la suite, avec la création de l’Institut national du cancer en 2004, on a pu sembler confirmer la pertinence de ce modèle intégrant autour d’une même pathologie l’ensemble des disciplines de recherche avec une forte implantation dans le domaine clinique. Le champ particulier de la recherche sur le VIH et les hépatites, et désormais aussi celui les maladies infectieuses émergentes, dispose d’un financement propre assez bien doté via une agence dédiée (ANRS-MIE). L’agence spécialisée ANRS créée en 1988, dédiée à la recherche contre le VIH et les hépatites, a en effet vu son champ élargi à la recherche sur les maladies émergentes en 2021. Il en est de même pour le cancer avec l’INCa (Institut National du Cancer). L’aspect positif du travail de ces agences concerne l’animation scientifique, parfois pluridisciplinaire, ainsi que le rapprochement et l’implication des associations de patients. Toutefois, on peut s’interroger sur le bien-fondé d’une démarche qui privilégie ces domaines de la recherche médicale, aussi importants soient-ils, par rapport aux autres qui ne bénéficient ni de tels financements ni d’une telle structuration. L’ensemble laisse planer le doute sur un effet d’aubaine inhérent à cette situation. |
Le programme d’investissements d’avenir (PIA) Celui-ci contribue à la recherche en sciences de la vie et parfois à sa structuration à travers les initiatives d’excellence (IDEX) (incluant les laboratoires d’excellence-LABEX) des universités à composante sciences de la vie, ainsi que les Instituts hospitalo-universitaires (IHU) et les recherches hospitalo-universitaires (RHU) en interface avec les hôpitaux et l’industrie. Se pose la question des modalités d’évaluation et de poursuite de ces actions en articulation avec les nombreuses instances existantes, en premier lieu universités, EPST et hôpitaux. |
2.4. Les limites du financement par projets
Les crédits de fonctionnement destinés à la recherche en biologie-santé sont attribués pour l’essentiel par projets (cf. supra). L’avantage de ce système est connu : la sélection et donc le financement des meilleurs projets. Cependant, il présente une série d’inconvénients qu’il ne faut pas sous-estimer et qui incitent à rechercher un meilleur équilibre entre financement par projet et dotation récurrente. Les crédits sont relativement modestes et alloués pour des durées limitées (en règle générale 3 ans). L’obtention de ces crédits requiert un travail important et long de préparation des dossiers pour un taux de succès qui reste assez faible, même s’il s’est accru récemment pour atteindre un peu plus de 20%. De ce fait, les équipes multiplient les demandes de crédits et y consacrent un temps excessif (sans compter le temps passé à l’évaluation des projets des autres chercheurs). Ce contexte crée un climat d’incertitude sur l’avenir des équipes qui n’est pas forcément propice à l’efficience de la recherche. Il tend à favoriser la construction de projets dont les résultats sont attendus à court terme aux dépens de projets plus originaux et à risque. En pratique, les chercheurs présentent souvent sous forme de données préliminaires les résultats attendus du projet pour convaincre le jury de la faisabilité et donc de la crédibilité du projet proposé. Ce système favorise aussi dans une certaine mesure au sein des équipes et des Instituts de recherche des attitudes plus individualistes dans la quête et l’utilisation des crédits de recherche.
A contrario, on sait bien que le meilleur facteur prédictif du succès d’un chercheur (d’une équipe) consiste dans la qualité du travail accompli au cours des années précédentes sur un temps suffisamment long, de l’ordre de 5 ans(xv). Cet état de fait plaide en faveur d’un système de dotation fondée sur une évaluation minutieuse du contenu et de l’impact des publications les plus importantes (sans utiliser de critères bibliométriques). Bien sûr, il en va différemment de l’appréciation des jeunes chercheurs dont l‘évaluation du projet est essentielle.
En 2005, la création de l’ANR reposait sur une volonté de pilotage thématique de la recherche. En réalité, ce pilotage thématique a conduit à un déclin du financement de la recherche fondamentale au profit de la recherche appliquée sur des thèmes dont la pertinence était loin d’être évidente. Or, il apparait crucial de préserver une recherche motivée par la curiosité et de privilégier les meilleurs projets. La recherche non-programmée a été initialement délaissée alors qu’elle est essentielle pour ouvrir les perspectives de nouvelles connaissances. Ce point a été en partie corrigé ces dernières années puisque les projets sur appel à proposition non ciblés sont devenus majoritaires.
La marge de manœuvre des EPST (et des universités) pour doter les équipes de recherche est modeste. Environ 10% des budgets des EPST sont attribués aux unités de recherche(xvi), car leur budget est engagé à hauteur de 80% dans les salaires. Cela amène à un double constat : 1) dotation insuffisante des équipes de recherche dans la durée avec une trop forte dépendance des équipes aux résultats des appels à financement par projet ; 2) marge de manœuvre insuffisante des EPST pour mener des actions d’intérêt stratégique. On peut y ajouter les difficultés des universités à faire émerger de nouvelles équipes. Cette situation pose la question de la mission des EPST dans le contexte de la recherche en France : opérateur gestionnaire des chercheurs et ITA (action qui pourrait être éventuellement mutualisée avec les universités) ou stratèges de la recherche fondamentale (CNRS), biomédicale et santé (Inserm) (cf. section 4).
2.5. Des méthodes d’évaluation critiquables
Le Haut Conseil de l’évaluation de la recherche et de l’enseignement supérieur (HCERES) est en charge de l’évaluation des équipes de recherche et des universités. Les procédures, bien qu’elles aient été récemment en partie simplifiées, restent assez lourdes. De plus, les conséquences pratiques de ces évaluations, leur impact sur l’évolution et le financement des équipes sont insuffisants eu égard aux efforts déployés. Ils font souvent l’objet d’une réévaluation par les tutelles qui en ont la charge. A noter que certains pays, comme l’Allemagne n’ont pas d’agence dédiée à l’évaluation.
Des efforts supplémentaires sont consacrés à l’évaluation des projets des équipes de recherche. A l’ANR, ce sont de l’ordre de 7000 projets par an qui sont évalués par quatre ou cinq évaluateurs, là encore un travail consommateur de temps. De facto, les équipes sont évaluées trop fréquemment, et l’évaluation est en partie de fait (par facilité) fondée excessivement sur des critères bibliométriques quantitatifs, plutôt que qualitatifs (impact réel des publications scientifiques…).
Il faut ici rappeler que de nombreuses entités de recherche (instituts…) disposent d’un « scientific advisory board », source de doublon d’évaluation avec celle du HCERES.
Globalement, cette évaluation est sans conséquences suffisantes. En réalité, les bonnes équipes sont freinées par une évaluation trop fréquente, tandis que les équipes moins performantes parviennent à survivre, alors qu’elles devraient être refondées. En résumé, l’état des lieux incite à rechercher une méthode d’évaluation dont les caractéristiques seraient 1) d’être moins fréquentes ; 2) plus approfondies : fondées sur des critères qualitatifs ; et 3) dont les résultats auraient des conséquences pratiques sur l’avenir des équipes (expansion, restructuration ou fermeture). Les deux premiers aspects concernent l’évaluation proprement dite, la troisième la politique des tutelles.
2.6. Les risques du découplage des différents domaines de recherche en santé
La réforme Debré de 1958 ayant mené à la création des CHU, de leur triple mission (soin, enseignement, recherche) et du temps plein hospitalo-universitaire fut une avancée considérable, entre autres pour la recherche en santé. Cette notion, qui ne peut plus être la règle à l’échelle individuelle, reste pertinente à l’échelle de l’équipe (service hospitalier). Mais cette intégration des missions est aujourd’hui difficile dans les faits. La place de la recherche (et de l’enseignement) a été réduite au sein de la gouvernance des CHU après la mise en place de la loi « Hôpital, patients, santé, territoires » en 2009, qui a réformé la gouvernance hospitalière. La place de l’université et des institutions de recherche est réduite à une portion congrue dans la programmation de la stratégie des CHU. Leur représentation au sein du conseil de direction ne leur confère guère de poids dans les prises de décision. Il en découle un repli sur soi de ces entités amenées à se concurrencer en termes d’objectifs et de stratégie de recherche ainsi que de valorisation des travaux.
Par ailleurs, le système des crédits des CHU gérés par le ministère de la santé, appelés « missions d’enseignement, de recherche, de référence et d’innovation » (MERRI)-MIGAC, présente d’évidents dysfonctionnements. Ces crédits, censés financer la recherche dans les hôpitaux, contribuent environ à hauteur de 10% au budget des hôpitaux. En pratique, ils sont plutôt utilisés par les directeurs de CHU par défaut comme un moyen d’équilibrer leur budget, plutôt que pour mener une politique de recherche et favoriser le travail des équipes performantes. De plus, les missions MERRI sont évaluées en grande partie par un indicateur quantitatif : les points accumulés fixent le montant de la dotation de chaque CHU. Ce « système d’interrogation de gestion, d’analyse des publications scientifiques » (SIGAPS) attribue des points par publication scientifique, sans réellement distinguer le poids d’une publication de premier plan par rapport à un article de bien moindre qualité (en gros, 8 articles du second type apportent autant de points qu’un article du premier groupe). Cet état de fait encourage la publication de nombreux articles d’intérêt modeste.
De plus, cet indice SIGAPS est malheureusement pris en compte dans de nombreux CHU pour l’évaluation des promotions au titre de Maitre de Conférence (MCU) et Professeurs des Universités (PU)-Praticien hospitalier (PH), un score « minimal » étant requis, plutôt que de se préoccuper du contenu et de l’impact de ces travaux. Une triple réforme est donc indispensable : des modalités de composition du score SIGAPS, de ses conséquences en termes d’attribution de crédits et de l’évaluation des nominations des MCU-PH et PU-PH.
La recherche clinique est soutenue par le Programme Hospitalier de Recherche Clinique (PHRC) créé en 1993 sans concertation avec les autres opérateurs des domaines de la recherche en biologie-santé, notamment l’Inserm ! Cette séparation ne fait pas sens, la recherche clinique ne peut être considérée indépendamment des actions de recherche translationnelle… Alors que ce programme dispose d’un budget relativement important (de l’ordre de 75M€ par an(xvii)), il n’a jamais fait l’objet à notre connaissance d’une quelconque évaluation de son efficience en presque 30 ans d’existence ! Lors d’un discours prononcé à l’occasion des 20 ans du PHRC, la ministre de la santé Marisol Touraine déclarait : « En deux décennies, plus de 5 000 projets de recherche clinique ont été financés pour un montant global de près de 860 millions d’euros. En deux décennies, plus de 1700 publications médicales ont permis de diffuser le travail et les découvertes de nos chercheurs. ». Il n’y aurait donc eu qu’un tiers des projets financés par le PHRC qui ont donné lieu à une publication : n’est-il pas problématique d’évoquer un succès(xviii) ? Disposer d’un financement par le PHRC est trop souvent considéré comme un « trophée » mentionné dans le CV du lauréat sans préoccupation excessive pour le résultat de la recherche. Un audit de ce programme est devenu indispensable et une réorientation concertée avec l’Inserm est sans doute la voie à suivre (cf. infra).
En 2010, la création d’Instituts Hospitalo-Universitaires (IHU) dans le cadre du Programme des investissements d’avenir (PIA), doit être considéré comme une avancée du fait de la création (ou du renforcement) de pôles intégrant recherche fondamentale, recherche translationnelle et recherche clinique sur un site hospitalier. La recherche nécessite aujourd’hui de concentrer en un lieu unique de multiples compétences avec des plateaux techniques ad hoc (des analyses génomique, protéomique, métabolomique, … aux animaleries et aux bases de données « intelligentes » sur les cohortes de patients). Cette condition, remplie par ces instituts confère une capacité d’attirer les meilleures équipes de recherche. Leur présence sur site hospitalier est une donnée fondamentale car seule à même d’assurer la continuité entre recherche et soins, et d’offrir la possibilité aux médecins/pharmaciens/soignants de l’hôpital de participer à l’effort de recherche. Cependant, leur existence reste encore limitée : sept IHU ont été créés (dont quatre à Paris), un a disparu et deux souffrent de problèmes de gouvernance. Leur nombre est insuffisant pour que leur impact sur la recherche biomédicale française soit perceptible.
Une autre difficulté réside dans la lourdeur de gestion administrative des projets de recherche tant précliniques que cliniques. Ce point a été souligné dans de très nombreux documents (cf. par exemple la présentation du programme d’innovation santé 2030) et n’est donc pas détaillé ici.
Y participe le mode d’organisation des directions à la recherche clinique et à l’innovation (DRCI) des CHU, parfois redondant avec les entités en charge au niveau de chaque hôpital ou groupes d’hôpitaux d’un CHU. On peut aussi regretter que ces DRCI soient pilotées par un administratif aussi compétent soit-il et non par une personnalité compétente en recherche médicale.
Enfin, le tissu de recherche en santé publique en France est insuffisant aussi bien au sein des CHU qu’à l’extérieur. La récente crise liée à la pandémie de Covid-19 a montré à quel point cette discipline est cruciale pour l’élaboration d’une politique de santé. Or, la France dispose de quelques excellents chercheurs/enseignants en épidémiologie, économie, sociologie… de la santé, mais à l’évidence leur nombre est insuffisant. Leurs connexions avec les autres domaines (et structures ad hoc) de recherche doivent être améliorées. Cette discipline doit être mieux valorisée à l’Université notamment, mais pas exclusivement dans les facultés de médecine. A cet égard, on peut regretter que la santé publique ne soit pas plus attractive aux yeux des internes en médecine.
La recherche en épidémiologie et en santé en général bénéficierait grandement d’un accès simplifié aux données de santé détenues par la Caisse Nationale d’Assurance Maladie (CNAM). On sait à quel point ce type de données est essentiel (et très recherché par le secteur privé). Plusieurs pays (Scandinavie, Royaume-Uni notamment) ont su concilier accès aux données de santé et respect de la confidentialité des données de santé individuelles. Il a été possible dans le contexte de la crise de Covid-19 de croiser les informations issues de plusieurs bases de données grâce à un travail de la CNAM (et de Santé Publique France) nécessaires au suivi de l’évolution de la pandémie. Ce qui a fonctionné en période de crise doit pouvoir devenir la règle et ainsi faciliter le travail des chercheurs.
Les forces du modèle hospitalo-universitaire néerlandais Aux Pays Bas, il y a 25 ans, une réforme des CHU a permis d’intégrer effectivement les missions de soins, d’enseignement et de recherche. Huit « UMC » (University Medical Center) soit 1 pour 2 millions d’habitants (ce qui équivaut à la densité des CHU en France) constituent les nœuds du système de santé hospitalier néerlandais, chacun ayant contractualisé les tâches de soin avec les hôpitaux non universitaires de proximité. Ces UMC assurent également les fonctions de recherche et d’enseignement sous l’égide d’une gouvernance originale mais qui s’est avérée efficace : un « triumvirat » (directeurs d’hôpital, de la recherche et de la faculté) dirige au quotidien chaque UMC. Une organisation « en râteau », par discipline avec un responsable pour chacune, est en charge de la triple mission qui est ainsi œuvre collective et non individuelle. Chaque département dispose d’un budget propre pour mener les trois activités. Ces départements sont soumis à évaluation externe tous les cinq ans. Cette réforme a résisté avec succès à l’épreuve du temps. Les performances de ces UMC non seulement en termes de soins mais aussi de recherche, de formation et d’innovation les placent régulièrement parmi les meilleurs établissements au monde (8/8 contre 8/30 CHU français parmi les 200 premiers au classement de Shanghai des CHU). Ce modèle n’est peut-être pas aisément transposable à la France mais il serait bon de s’en inspirer et sans doute de l’expérimenter là où le tissu de soins et de recherche le permet. La présence, comme c’est le cas actuellement d’un directeur de la recherche et du doyen auprès d’un directeur d’établissement hospitalier universitaire dont la primauté a été définie clairement par la loi HPST ne saurait faire office de gouvernance harmonieuse et efficace. |
2.7. Les faiblesses de la recherche privée
La recherche privée en France représente environ 1.4% du PIB sans évolution depuis plus de 20 ans, contrairement à la progression observée dans de nombreux pays (cf. figure 6).
Figure 6. Dépenses Intérieures de R&D des Entreprises (DIRDE) par pays en 2001 et 2019 (pourcentage du PIB)

Sources : INSEE, World Bank, OECD
Le Crédit Impôt Recherche (CIR), réduction d’impôt calculée sur la base des dépenses de recherche et développement engagées par les entreprises, représente un soutien de l’État à hauteur de 7Md€ annuels. Bien qu’il soit difficile d’en évaluer directement l’impact[10], force est de constater qu’il n’a pas permis d’augmenter la part du privé dans les dépenses de recherche : il a certainement contribué à corriger le déficit de compétitivité des entreprises industrielles françaises par rapport à leurs principales concurrentes étrangères en réduisant l’écart de fiscalité entre les unes et les autres, mais il n’a pas réellement dopé l’effort de recherche qu’il était censé soutenir.
On peut en particulier s’interroger sur l’opportunité de soutenir l’effort de recherche des grandes entreprises à travers le CIR. Il est clair que les entreprises de santé ont en grande partie externalisé leur R&D, en recourant plus souvent au rachat de biotechs performantes. Sanofi a par exemple racheté en août 2021 pour 3,2Mds de dollars la biotech américaine Translate Bio, spécialiste des thérapies et vaccins à base d’ARNm.
Le développement des biotechs et start-ups en biologie vient dynamiser la recherche privée en biologie-santé en France, mais ces structures sont insuffisamment soutenues une fois passées les premières étapes de développement, et se trouvent souvent en difficulté pour trouver des financements après un certain nombre d’années. Il semble que le plan Innovation santé 2030 propose une solution possible d’aide (cf. infra).
Un aspect culturel insidieux est sans doute historiquement présent dans ce retard de la recherche industrielle en France (malgré de brillantes exceptions) : les ingénieurs ne sont pas suffisamment incités à poursuivre une formation scientifique par la recherche à travers un travail de thèse. Alors qu’en Allemagne deux tiers des ingénieurs ont un diplôme de PhD, ils représentent seulement 15 à 20% des ingénieurs français. Or, ce sont eux qui seront amenés à diriger nombre d’entreprises. La plupart des dirigeants des industries n’ont pas suivi de formation scientifique par la recherche et peuvent être enclins à accorder une moindre considération à son importance pour leur entreprise.
La reconnaissance du diplôme de docteur en sciences prévue en principe dans la LPR est de nature à améliorer l’emploi et les conditions d’emploi des chercheurs dans le secteur privé (et les institutions publiques hors recherche). A terme, il pourrait favoriser la prise en compte de la recherche dans les entreprises en suivant le modèle allemand.
2.8. Science et société : le manque de culture scientifique
Il est de fait que la culture scientifique de la population mais aussi des dirigeants est très insuffisante en France. Les différents éléments en sont évoqués dans l’avis du député Philippe Berta sur le projet de Loi de finances pour 2023(xix). Citons-en quelques points :
- La place de l’éducation scientifique à l’école est encore trop faible, malgré des initiatives remarquables comme la Fondation « La main à la pâte » ; les enfants ne sont pas suffisamment formés à la méthode scientifique, à la rigueur qu’elle impose et à la nécessité de formuler des questions et des hypothèses.
- Les associations qui développent des actions de culture scientifique sont insuffisamment reconnues dans le milieu scolaire
- S’il s’agit d’une tâche difficile pour les journalistes, qui manquent trop souvent d’une formation de base en sciences, la diffusion de données scientifiques correctes à la population par les médias est un enjeu crucial comme l’a illustré la pandémie de Covid-19.
Cette faible culture scientifique se retrouve chez les décideurs politiques (à titre d’exemple, aucune formation scientifique n’était jusqu’ici dispensée à l’ENA). Alors que dans les pays anglo-saxons, les experts scientifiques notamment des Académies des sciences, sont présents pour informer et conseiller à tous les niveaux décisionnels, en France trop peu d’expertise scientifique est disponible auprès des décideurs politiques (et industriels). L’OPECST (office parlementaire d’évaluation des choix scientifiques et technologiques) permet la rencontre entre scientifiques et députés/sénateurs, mais ses modalités de fonctionnement ne permettent que des échanges trop limités avec la communauté scientifique.
La réforme du lycée général a envoyé un mauvais signal en considérant que le tronc commun des matières obligatoire serait principalement centré sur les humanités, les disciplines scientifiques étant elles optionnelles. L’aménagement récent n’a pas réellement rééquilibré le dispositif. Globalement la place des enseignements scientifiques a diminué à la suite de la réforme.
Que penser des efforts récents en faveur de la recherche et l’innovation ? La loi de programmation de la recherche de 2020 Le vote de la loi de programmation de la recherche fin 2020 témoigne d’une prise de conscience de la situation difficile de la recherche en France et d’une volonté d’y remédier. L’effort financier de 26 milliards d’€ supplémentaires en 10 ans n’est pas négligeable. On peut néanmoins s’interroger sur l’impact de la loi au cours des 5 dernières années du plan. Malgré un effort de revalorisation des revenus des personnels de recherche, on ne peut considérer que celui-ci soit suffisant. En effet, il ne permettra pas de rattraper le niveau de rémunération des chercheurs et universitaires des pays voisins, et ce ni en début ni en fin de carrière. Il ne représente pas un « choc d’attractivité » susceptible d’attirer de bons étudiants vers les métiers de l’enseignement et de la recherche au lieu d’activités professionnelles plus rémunératrices. Si l’augmentation sensible du budget de l’ANR doit être saluée, elle ne s’accompagne pas d’un effort similaire (voire supérieur) en ce qui concerne les dotations récurrentes des laboratoires de recherche actuellement si faibles. Il en résulte que le déséquilibre entre financement de la recherche par projet et financement récurrent va encore s’accentuer, un choix discutable (cf. section 2.4). La facilitation des pré-recrutements (« Tenure track »), que ce soit à l’Université ou dans un établissement de recherche, est une mesure intéressante en termes d’attractivité, mais encore faut-il s’assurer du niveau de ces candidats qui échappe à une évaluation comparative telle qu’effectuée lors du recrutement de chercheurs dans les EPST. Ces postes pourraient s’appuyer sur l’Institut Universitaire de France, dont c’était la mission initialement prévue et permettre aux Universitaires une décharge partielle d’enseignement. En ce qui concerne la recherche biomédicale, il est fait état dans la loi de la mise en place d’un « comité territorial sur la recherche en santé » autour de chaque CHU. On peut s’interroger sur l’intérêt d’ajouter une instance supplémentaire de gouvernance de la recherche médicale dans un paysage déjà fort complexe et peu lisible. On peut regretter que les questions spécifiques du financement et de l’organisation de la recherche en CHU ne soient pas traitées. On aurait pu espérer un effort de simplification et de mise en cohérence des différents acteurs de la recherche biomédicale. Le Plan innovation santé 2030 Le Plan Innovation santé 2030, présenté le 29 juin 2022 par le Président de la République, vise à renforcer la recherche biomédicale. Ce plan, qui mobilise largement le Programme d’investissements d’avenir (PIA), bénéficiera d’un budget de 7 milliards d’euros. Les mesures retenues ont notamment pour objectif de transformer le paysage de la recherche biomédicale française en regroupant le soin, la recherche et l’innovation au sein de pôles d’excellence. Les biothérapies, la santé numérique et les maladies infectieuses émergentes, bénéficieront de plans d’investissements dédiés. Le plan prévoit également le soutien à l’investissement industriel par des appels à projet et l’appui à l’émergence, à la croissance et à l’industrialisation de start-ups par BPI France. Dans un contexte d’avancées scientifiques remarquables (médecine de précision, intelligence artificielle, biothérapies), on peut se réjouir du fait que l’État apporte des moyens complémentaires pour développer les outils de la santé de demain, en simplifiant la mise en place et faisant en sorte de renforcer le tissu industriel national. Cependant, il nous semble que ce plan ne prend pas suffisamment en compte un élément essentiel : l’innovation nécessite en amont une recherche active et efficace, tant dans ses dimensions publiques que sur son versant privé. On peut regretter que l’accent ne soit donc pas également placé sur cet axe qui ne bénéficiera que d’une part très minoritaire des financements prévus (environ 1 Md€ sur 7 Mds€). Pas d’innovation sans recherche, les deux sont étroitement liés dans une forme de « coproduction » ; il serait donc souhaitable d’accompagner les investissements en innovation d’un effort analogue pour la recherche, dont on a vu plus haut qu’elle était moins bien financée que chez nos concurrents directs. Par exemple, développer des structures de bioproduction (c’est-à-dire médicaments thérapeutiques innovants tels que thérapies cellulaire, tissulaire et génique) est indiscutablement nécessaire – mais encore faut-il s’assurer que la recherche française sera performante dans ces secteurs. Les structures existantes, dont les EPST, n’apparaissent que peu impliquées dans ce plan alors qu’ils constituent le terreau de la recherche publique concernée. On peut saluer la volonté de simplification administrative de la recherche clinique – encore que les mesures proposées paraissent assez modestes. Dans le paysage pour le moins complexe de la recherche/innovation, comment s’articulera la nouvelle « Agence Innovation Santé » avec les structures existantes ? On remarque que la volonté de simplification ne s’accompagne dans le plan d’aucune suppression d’entité existante. Enfin, un plan d’innovation en santé devrait par ailleurs mieux prendre en compte le potentiel d’innovation dans le domaine des maladies rares – moins propice au développement industriel. |
3. Quelles propositions pour renforcer la recherche en biologie-santé ?
Une action résolue, visible et durable est nécessaire pour promouvoir les activités de recherche dans notre pays. Cette action comporte un volet financier et organisationnel. Elle doit aller bien au-delà des efforts prévus par la Loi de programmation de la recherche 2021–2030 et spécifiquement pour le secteur biomédical du Plan « Innovation santé 2030 ». Cet effort est indispensable pour restaurer l’attractivité des métiers de la recherche et de l’Université.
3.1. Le financement de la recherche
L’augmentation du budget de la recherche doit tendre vers une hausse substantielle pour atteindre enfin l’objectif des 3% du PIB et le dépasser, comme c’est aujourd’hui le cas de plusieurs pays dont l’Allemagne. Les effets de la LPR ne permettront pas, et de loin, d’atteindre cet objectif même à l’horizon 2030. L’effort mené au cours des 15–20 dernières années par l’Allemagne devrait servir d’exemple. L’effort doit porter tant sur la composante publique qui devrait dépasser 1% du PIB (l’objectif du Conseil européen fixé en 2021 est de 1,25%), que sur la composante privée.
La revalorisation des salaires tout au long de la carrière des enseignants-chercheurs, des chercheurs, des ingénieurs techniciens et administratifs dans les établissements de recherche comme dans les universités est une priorité – avec comme objectif de rejoindre le plus rapidement possible le niveau des pays comparables (Allemagne, Royaume-Uni). Une attention particulière doit être apportée aux salaires des étudiants en thèse et des chercheurs postdoctoraux. En ce qui concerne le personnel titulaire, la question se pose d’une revalorisation du salaire qui serait en principe préférable aux primes, même si ces dernières sont plus faciles à mettre en œuvre.
Depuis la création de l’ANR en 2005, l’accent a été mis en France sur le financement de la recherche par projets au détriment des dotations récurrentes d’équipes par les établissements de recherche et dans une moindre mesure les universités. Il nous semble nécessaire de rétablir un meilleur équilibre en augmentant significativement les dotations d’équipes. Cette situation présente deux avantages et comporte une condition : 1) donner aux équipes une perspective budgétaire sur quelques années tout en réduisant la course permanente aux crédits de recherche et 2) promouvoir un sentiment d’appartenance et donc de travail collectif au sein des équipes de recherche. Une telle mesure implique cependant que l’évaluation quinquennale des équipes soit effectivement suivie d’effets : croissance / réduction / restructuration / fermeture le cas échéant, afin d’optimiser l’utilisation des fonds disponibles. Ce point doit constituer un élément essentiel d’évaluation des Instituts de recherche auxquels sont affiliées ces équipes.
La dotation de l’ANR a permis d’augmenter sensiblement le taux de succès de financement des projets. Néanmoins, les montants alloués par projet restent relativement modestes. Il convient aussi de renforcer la part de projets financés sur appel non thématisé, en suivant le modèle de l’ERC, afin de privilégier le financement des meilleurs projets, les plus à même de faire progresser les connaissances, quel qu’en soit le domaine.
Dans le cas de l’évolution des EPST en agences de moyens, (cf. infra), on pourrait envisager de réattribuer ces appels à projet aux EPST. En effet, la France finance la recherche à travers trois entités : université + EPST (ou EPIC) + ANR quand nos voisins en utilisent deux : équivalent d’EPST ou ANR + université. Une telle mesure de simplification serait la bienvenue ! Si l’ANR devait continuer à jouer un rôle prépondérant, il serait nécessaire que les conditions de financement suivantes soient remplies : taux de succès supérieur à 25%, augmentation des crédits alloués, allongement à 5 ans de la durée des contrats et simplification administrative.
Chaque année, l’État accorde par ailleurs un crédit d’impôt aux entreprises en fonction de leur activité de recherche et développement : le crédit impôt recherche (CIR) dont le montant actuel est d’environ 7 milliards d’Euros. L’efficacité de ce dispositif dans la promotion de la recherche industrielle n’a pas été clairement démontrée si l’on se réfère au fait que la part de la recherche privée dans le PIB (autour de 1,4%) est stable depuis de nombreuses années. On y reviendra plus loin, mais il pourrait être envisagé d’en restreindre l’utilisation aux petites et moyennes entreprises en développement. Les sommes économisées pourraient être utilisées à profit pour la promotion des activités de recherche (cf. supra).
Europe et recherche L’Union Européenne s’est engagée fortement dans le soutien des activités de recherche et développement et ce depuis de nombreuses années. La mise en place du programme de contrats de l’ERC (cf. supra) fut une initiative structurante du maintien en Europe d’une recherche fondamentale et appliquée de très haut niveau. On ne peut que souhaiter voir ce programme se renforcer encore afin de financer un plus grand nombre de chercheurs à tous les stades de leur carrière, tout en préservant le principe de liberté et de soutien de l’excellence. Par ailleurs, les projets regroupant des équipes de plusieurs pays ont le mérite de favoriser la coopération scientifique européenne et d’en accroitre la visibilité internationale. Une simplification de son administration serait aussi appréciable. Sur un plan différent, l’Union Européenne se doit de développer les initiatives de recherche sur les risques sanitaires qui sont partagées. En ce sens la création de HERA (autorité européenne de préparation et de réaction en cas d’urgence sanitaire) est à saluer, malgré ses limites. Nous avons choisi de ne pas développer ces points dans le cadre de cette note. Ils mériteraient d’être traités en tant que tels. |
3.2. L’évaluation de la recherche
Pour ce qui est de l’évaluation des équipes, elle pourrait être simplifiée et se fonder sur une évaluation a posteriori (essentiellement la production scientifique évaluée qualitativement à partir d’un petit nombre de publications choisi par l’équipe) associée à un bilan d’impact de ces recherches et une brève présentation du projet.
Un point essentiel évoqué plus haut consiste dans la prise en considération des résultats de l’évaluation dans les décisions sur l’avenir d’une équipe (de façon positive ou négative). La question de l’institution en charge de l’évaluation des équipes de recherche doit être posée : est-ce le HCERES comme actuellement ou bien plutôt l’organisme dont dépend l’équipe, ce qui représenterait une mesure de simplification ? Les chercheurs et ITA sont évalués par les organismes. Il y aurait tout intérêt à coupler évaluation d’équipe de recherche et des individus. Le rôle du HCERES devrait se concentrer sur l’évaluation des grosses entités de recherche, des universités et des organismes de recherche.
Les procédures d’évaluation des projets de recherche clinique devraient être redéfinies et sans doute confiées à l’Inserm (cf. infra) plutôt qu’à une commission ad hoc.
D’une manière générale, le recours à des indices quantitatifs (indice de citation, H index, score SIGAPS en médecine…) devrait être utilisé avec circonspection et certainement pas lors de l’évaluation de personnes. De ce point de vue, la toute récente initiative européenne de créer une coalition pour la réforme de l’évaluation de la recherche (COARA) doit être saluée. Elle a pour ambition non seulement de limiter l’usage des critères quantitatifs, mais aussi de faciliter la reconnaissance d’autres contributions à la recherche que les seuls articles.
3.3. La gouvernance de la recherche
L’organisation en mille-feuilles de la recherche médicale évoquée plus haut, nuit à son efficience du fait de la complexité, de la perte de temps et du découragement qu’elle engendre. Elle est aussi responsable dans certains cas d’effets d’aubaine évitables. Simplifier et mieux organiser le parcours de recherche en sciences de la vie/médecine nous paraît une action prioritaire. Cette réorganisation serait d’autant plus réalisable que le contexte financier (augmentation souhaitée des budgets, Plan Innovation santé 2030) créerait un climat propice.
Plusieurs solutions de simplification sont envisageables. Celle qui nous parait le plus logique consiste à confier à l’Inserm une mission globale couvrant l’ensemble du champ de la santé sous forme d’une agence de moyens réunissant, en plus de la dotation de l’Inserm (qui doit être réévaluée à la hausse), les fonds de recherche de l’ANRS-MIE, de l’INCa et du PHRC. Il en résulterait pour l’Inserm une capacité d’action stratégique et notamment de coordination et de mise en pertinence du lien entre recherche translationnelle et clinique. Serait attendue d’un tel Inserm une capacité d’animation des différents champs scientifiques et de réactivité en cas de situation nouvelle ou critique. Sa capacité d’action serait incomparablement supérieure à celle d’Aviesan (alliance pour les sciences de la vie et en santé), entité de coordination inter-organismes mais qui n’a guère de moyens d’action. Cette mission devrait par ailleurs rendre plus attractive la position de direction d’organismes, qui pourrait être dans ce contexte réévaluée.
Une telle modification soulève plusieurs questions. Si l’Inserm (et le CNRS) sont transformés en agence de moyens, les universités sont-elles toutes en situation d’agir comme opérateur ? Une expérimentation paraît souhaitable. La transformation de l’Inserm en agence de moyens la rapprocherait quelque peu de la mission de l’ANR pour la recherche biomédicale. On propose de confier le financement par projets à l’Inserm, au CNRS et autres établissements de recherche et EPIC dans leurs champs disciplinaires respectifs. Une telle décision réduirait considérablement la mission de l’ANR, mais elle aurait l’avantage de simplifier le paysage du financement de la recherche qui passerait de trois entités (universités/EPST/ANR) à deux, comme c’est le cas dans les autres pays développés. Un autre avantage serait de permettre aux établissements de piloter plus finement le délicat équilibre entre financement récurrent et financement par projets.
3.4. Les CHU
Le modèle des CHU mis en place en 1958 a besoin d’être réformé pour prendre en compte les évolutions tant des pratiques de soins que de recherche. Il n’est pas dans nos intentions d’évoquer ici les adaptations nécessaires de l’organisation des soins. Néanmoins, il nous paraît indispensable de revenir sur la prééminence accordée à la direction hospitalière au sein des CHU telle qu’elle a été mise en place par la loi HPST de 2009. Un rééquilibrage de la gouvernance avec les directeurs d’UFR et les acteurs de la recherche est de nature à améliorer le fonctionnement global et de ce fait à favoriser l’attractivité des CHU. En dépend la fluidité des diverses missions de recherche des CHU dans le domaine des cohortes, des analyses multimodales fondées sur les outils de l’intelligence artificielle, des biobanques et de la recherche expérimentale et enfin thérapeutique. Hôpitaux, universités et instituts de recherche ne peuvent ni ne doivent plus travailler séparément comme on peut trop souvent le voir y compris sur un même site ! L’intégration complète des trois missions tant dans la gouvernance que dans l’organisation telle qu’elle a été mise en place aux Pays-Bas et dans quelques CHU d’autres pays constitue sur ce plan un modèle à considérer pour s’en inspirer et expérimenter.
L’exigence de la recherche moderne implique la constitution de masses critiques d’experts multidisciplinaires et réunis en un même lieu à proximité des unités de soins. Sur ce plan, les IHU représentent un modèle pertinent, pourvu que soit mise en place une évaluation a posteriori solide de leurs activités par les tutelles. Il parait souhaitable d’en augmenter progressivement le nombre pour renforcer les capacités de la recherche médicale en France. Ces sites sont susceptibles d’attirer en France des chercheurs de haut niveau, français ou étrangers, et surtout de jeunes scientifiques, médecins et pharmaciens désireux d’investir ce champ de recherche. Ces instituts ne peuvent cependant constituer à eux seuls l’ensemble de la recherche médicale. Il est souhaitable de garder la souplesse et la réactivité nécessaires pour promouvoir les équipes et leurs activités de recherche lorsqu’elles le méritent, même lorsqu’elles travaillent sur des sites de taille plus petite hors IHU.
La formation des jeunes médecins/pharmaciens futurs cadres des CHU doit faire l’objet d’une attention particulière. Les plus motivés d’entre eux doivent pouvoir bénéficier d’un parcours de double formation (« MD/PhD » ou « PharmD/PhD ») en sécurisant et peut-être en déployant plus avant les modalités existantes (école de l’Inserm, formation universitaire ad hoc) et en finançant des programmes de temps protégé avec subvention de recherche (sur le modèle ATIP-AVENIR) pour les chefs de clinique assistants.
Simplifier et faciliter les démarches d’accompagnement des projets de recherche sur l’humain (cohortes, préclinique et clinique) est indispensable. Le Plan Innovation Santé 2030 prévoit un certain nombre de mesures utiles qui ne sont pas reprises ici. Au niveau local (CHU), une réforme des directions de la recherche clinique et de l’innovation (DRCI) est nécessaire, elle impliquerait un pilotage médical et non plus administratif et une meilleure coordination avec les structures de terrain comme les unités de recherche clinique (URC) et les centres d’investigation clinique (CIC). L’intégration des missions des CHU (cf. supra) faciliterait une telle mise en œuvre.
3.5. La recherche en santé publique
L’importance, s’il est besoin de le rappeler, de la recherche en santé publique a été soulignée par la pandémie de Covid-19. Travaillent en France des équipes de haut niveau notamment en épidémiologie et en économie de la santé. Le constat est néanmoins partagé d’une masse critique globalement insuffisante. On peut suspecter que la faible culture de prévention en santé dans notre pays et l’intérêt modéré voire faible des jeunes médecins pour la santé publique en sont le témoin, et peut-être un élément d’explication. Dans ce contexte, il convient de proposer une politique proactive en faveur de cette discipline dans toutes ses dimensions (épidémiologie, modélisation, sociologie, anthropologie, économie, psychologie…), notamment à l’université (au sein des facultés de médecine mais aussi à l’extérieur) par la création progressive de postes d’enseignants-chercheurs. La place de la santé publique dans les études médicales (et dans la formation aux autres professions de santé) doit être sans doute revue afin d’améliorer la culture de base des futurs professionnels de santé mais aussi afin de susciter des vocations. En miroir, une sensibilisation accrue aux questions de santé dans les études des sciences humaines et sociales devrait être aussi envisagée.
L’accès aux bases de données de la CNAM, ainsi qu’à d’autres bases de données en santé (et a fortiori leur croisement) est très contraint du fait des restrictions inhérentes à la protection de la confidentialité des données individuelles. Cette situation est un obstacle sérieux au développement de travaux d’épidémiologie en France en comparaison avec d’autres pays (Royaume-Uni, Scandinavie) qui pourtant ne sacrifient pas le respect de la confidentialité des données. La facilitation de l’accès aux données en particulier de la CNAM (d’une très grande richesse) et du croisement d’information comme cela a pu être accompli dans le contexte du suivi des indicateurs de la pandémie de Covid-19 est un enjeu majeur du futur de la recherche en santé publique en France et, plus largement, de l’action de santé publique.
3.6. La recherche privée
Un point d’inquiétude est la stagnation du poids total de la recherche privée (1,4 % du PIB), loin des objectifs fixés à Lisbonne par la communauté européenne et loin des performances de nombreux pays. On peut relever comme points positifs l’existence d’un grand nombre de start-ups performantes, les mesures facilitant l’interface recherche académique/privée prévues dans la LPR (création notamment d’unités mixtes) ainsi que les investissements importants pour l’aide à l’activité R&D programmée dans le Plan Innovation Santé 2030. Espérons que ces mesures seront suivies d’effets, contrairement au constat du manque d’efficacité du CIR (cf. supra) dont le dernier rapport de la CNEPI(xx) s’est fait l’écho en 2021. De fait, l’OCDE(xxi) a récemment montré que les aides fiscales à la R&D se traduisent par un surcroît de dépenses de R&D relativement plus faible en France que dans les pays où l’aide fiscale est moins généreuse et ciblée en général sur les entreprises de taille modeste. Le soutien aux entreprises innovantes de taille moyenne est sans doute déterminant.
On pourrait proposer qu’au fur à mesure que baisse la fiscalité sur les entreprises et notamment les impôts de production, il serait pertinent de baisser progressivement le soutien du CIR. En conclusion, il faudrait resserrer progressivement le CIR sur les TPE/PME et les ETI.
Au-delà de ces incitations fiscales, on peut néanmoins s’interroger sur le retard de la France en termes d’investissements R&D (malgré de brillantes exceptions) et proposer, entre autres hypothèses d’explication, un lien avec le manque, en moyenne, de culture scientifique des dirigeants d’entreprise en France. Il est aussi notable d’observer que les directions de recherche occupent des positions hiérarchiques souvent secondaires au sein des entreprises. Le fait que relativement peu d’ingénieurs en France aient une formation scientifique complémentaire (PhD) comparé à l’Allemagne par exemple peut être un élément d’explication. Dans ce contexte, il parait raisonnable de préconiser le fait que les conventions collectives reconnaissent le diplôme de thèse en sciences (PhD), ce qui inciterait les jeunes docteurs à travailler en entreprise, et renforcerait à terme la place des activités de R&D au sein des entreprises.
Enfin il y a tout intérêt à favoriser le développement de clusters de start-ups autour des pôles forts de recherche comme observés par exemple à Munich ou à Lausanne.
3.7. La culture scientifique
Le constat d’une place croissante d’une certaine forme de scepticisme et de relativisme dans la société et les médias à propos de la recherche scientifique et de ses applications (pensons aux OGM et dans une certaine mesure aux vaccins) est indiscutable. La promotion d’une culture scientifique chez nos concitoyens à travers l’éducation à la rationalité, au raisonnement scientifique, à l’esprit critique, à la connaissance des ordres de grandeur pour apprécier les avantages et les risques et à la compréhension du sens de termes comme concomitance (coïncidence), corrélation et causalité apparait comme un objectif minimal.
La réflexion sur ces thèmes a fait l’objet de nombreux travaux et beaucoup d’initiatives d’associations comme « science ouverte » en milieu socialement défavorisé ont vu le jour. Il est proposé que 1% des fonds nouveaux dans le cadre de la LPR soutienne les actions de promotion de la culture scientifique. Sans doute faudra-t-il aller au-delà. L’école est bien sûr un lieu privilégié d’action et l’on rêverait de voir se généraliser l’action de la Fondation La main à la pâte, ce qui impliquerait de renforcer la formation scientifique des professeurs des écoles mais aussi des collèges et des lycées. Ajoutons que l’éducation à la santé au sein des établissements scolaires devrait être renforcée et intégrer la vaccination en milieu scolaire, comme c’est le cas dans de nombreux pays européens : outre son intérêt évident en santé publique, ce modèle représenterait aussi une opportunité de faire comprendre ce qu’est la science et l’importance de la recherche scientifique.
Renforcer la culture scientifique des journalistes des principaux médias dans les écoles de journalisme et au cours de leurs carrières est un autre objectif. Il serait souhaitable qu’un beaucoup plus grand nombre de scientifiques s’engage dans cette voie et dans l’intervention dans le débat public à chaque fois qu’un éclairage scientifique est nécessaire. Les organismes et les Universités devraient s’employer à la formation des enseignants-chercheurs et chercheurs à la prise de parole en public. Leur participation à des émissions de qualité dans les services publics de la radio et de la télévision, comme on peut le voir dans les programmes de la BBC au Royaume-Uni, serait une mesure utile susceptible de redonner crédit à la pertinence de la culture scientifique en tant que telle et comme élément d’approche des questions sociétales.
Cela implique en corollaire de tout mettre en œuvre pour réduire l’intervention dans les médias de scientifiques qui s’abritent derrière leur affiliation (universités, IHU, CNRS, hôpitaux…) pour propager de fausses nouvelles comme on a pu le voir au cours de la pandémie de Covid-19. C’est un point important et délicat. Important car la plupart des fausses nouvelles en santé et en environnement émanent de personnalités scientifiques parfois renommées, et elles sont ensuite relayées par divers médias. Délicat car le principe de la liberté d’expression ne peut être remis en cause. Néanmoins une réflexion pourrait s’ouvrir sur la mise en place d’une forme de veille déontologique de la part des institutions auxquelles sont affiliés les chercheurs. La vigilance des journalistes (cf. supra) et une meilleure culture des citoyens pourrait être des garde-fous mais ils sont insuffisants. Au minimum, on devrait exiger que de telles expressions ne puissent être associées à une affiliation scientifique et qu’en cas de non-respect de ces consignes, les établissements publics concernés s’expriment haut et fort dans les médias, et ce de façon systématique, pour répliquer aux fausses assertions. Cela implique la mise en place d’une forme de « veille médiatique » des responsables concernés. En parallèle, la vigilance à l’égard des conflits d’intérêt doit être maintenue lorsque ceux-ci sont réels.
L’attractivité des métiers de la recherche implique une meilleure diffusion de la culture scientifique au sein de notre société. Il faut prendre en compte les barrières sociales et de genre, source tout autant d’injustice (inégalité des chances) que de privation de talents. La place des femmes dans les recherches en sciences de la vie et en santé est meilleure que dans les autres secteurs de la science. Mais cette situation reflète peut-être en fait un point négatif : la faible attractivité et la perception sociétale résiduelle d’un caractère peu « féminin » des disciplines scientifiques à composante mathématique. Quel que soit le champ disciplinaire, il faut poursuivre sans relâche les efforts afin que les femmes scientifiques accèdent aux positions de responsabilité, d’expertise et qu’elles soient justement reconnues (prix scientifiques, membres d’Académies…). Leur visibilité sociétale est un élément d’attractivité et sert d’exemple pour les plus jeunes.
Sur un autre plan, il est souhaitable de développer l’implication des experts dans le domaine des recherches en sciences et santé comme dans tous les autres domaines scientifiques auprès des instances dirigeantes en s’inspirant des pratiques en vigueur dans le monde anglosaxon. Il n’est guère aujourd’hui de sujets qui ne nécessitent, pour éclairer la décision politique, une expertise approfondie. Dans le contexte de la crise de Covid-19, la mise en place de conseils d’experts ad hoc constitue à notre sens une avancée, mais il conviendrait de définir les modalités et la pratique de l’expertise hors crise.
Conclusion
Ce texte reflète essentiellement des réflexions personnelles fondées sur une longue expérience de recherche biomédicale à Paris et sur une assez bonne connaissance des systèmes en vigueur à l’étranger. Il ne résulte pas du travail d’un groupe d’experts et est de ce fait sujet à erreurs et omissions. Une analyse comparative plus fouillée des performances et des caractéristiques de la recherche biomédicale en France et dans les pays comparables est sans aucun doute nécessaire pour mieux étayer le diagnostic du retard français dans ce domaine. Par ailleurs, ce document n’a pas pour intention de couvrir de façon exhaustive toute la problématique de la recherche biomédicale.
L’analyse et les propositions qu’il inclut ont pour objectif de susciter un débat en espérant qu’il puisse aboutir dans un délai proche à une réforme ambitieuse de notre politique de recherche, en particulier dans le domaine des sciences de la vie et de la médecine. L’enjeu tant culturel qu’économique est d’une importance suffisante pour le justifier.
Références
(i). DREES (2020). En 2020, l’espérance de vie sans incapacité à 65 ans est de 12,1 ans pour les femmes et de 10,6 ans pour les hommes | Direction de la recherche, des études, de l’évaluation et des statistiques. Accessed November 25, 2022. https://drees.solidarites-sante.gouv.fr/publications/etudes-et-resultats/en-2020-lesperance-de-vie-sans-incapacite-65-ans-est-de-121-ans
(ii). GHE: Life expectancy and healthy life expectancy. Accessed November 25, 2022. https://www.who.int/data/gho/data/themes/mortality-and-global-health-estimates/ghe-life-expectancy-and-healthy-life-expectancy
(iii). Pour une nouvelle politique de la recherche ! | Rapports, ouvrages, avis et recommandations de l’Académie | Assurer un rôle d’expertise et de conseil. Accessed December 18, 2022. https://www.academie-sciences.fr/fr/Rapports-ouvrages-avis-et-recommandations-de-l-Academie/pour-une-nouvelle-politique-de-la-recherche.html
(iv). Ardaillou R, Barthélémy C, Berche P, et al. La recherche en biologie-sante : prospectives. Bull Académie Natl Médecine. 2022;206(8):923–930. doi:10.1016/j.banm.2022.07.002
(v). Hcéres O. La position scientifique de la France dans le monde et en Europe: Hors Murs. 2021;N° 509(8):18–22. doi:10.3917/ehlm.509.0018
(vi). 2022 tables | Annual Tables | Nature Index. Accessed September 7, 2022. https://www.nature.com/nature-index/annual-tables/2022
(vii). Office EP. Statistics and trends. Accessed September 12, 2022. https://www.epo.org/about-us/annual-reports-statistics/statistics.html
(viii). Prix Louis Jeantet – Lauréats. Accessed October 18, 2022. https://www.jeantet.ch/prix-louis-jeantet/laureats/2022/
(ix). Cour des Comptes (2022). La recherche en infectiologie – Un enjeu fort insuffisamment piloté. Accessed November 25, 2022. https://www.ccomptes.fr/system/files/2022–02/20220210-recherche-en-infectiologie.pdf
(x). Eurostat (2022). R&D expenditure. Accessed September 7, 2022. https://ec.europa.eu/eurostat/statistics-explained/index.php?title=R%26D_expenditure
(xi). After vaccine failures, France laments biomedical decline | Science. Accessed September 8, 2022. https://www.science.org/doi/10.1126/science.372.6540.331
(xii). MESRI (2022). L’État de l’Enseignement supérieur, de la Recherche et de l’Innovation en France. Accessed September 7, 2022. https://publication.enseignementsup-recherche.gouv.fr/eesr/FR/
(xiii). L’état de l’emploi scientifique en France – Rapport 2020. vie-publique.fr. Accessed September 8, 2022. https://www.vie-publique.fr/rapport/276854-etat-de-l-emploi-scientifique-en-france-rapport-2020
(xiv). MESRI (2022). Les moyens humains de la recherche et développement – état de l’Enseignement supérieur, de la Recherche et de l’Innovation en France n°15. Accessed September 11, 2022. https://publication.enseignementsup-recherche.gouv.fr/eesr/FR/T497/les_moyens_humains_de_la_recherche_et_developpement/
(xv). Germain RN. Healing the NIH-Funded Biomedical Research Enterprise. Cell. 2015;161(7):1485–1491. doi:10.1016/j.cell.2015.05.052
(xvi). HCERES (2021). Rapport d’évaluation INSERM. Accessed November 25, 2022. https://www.hceres.fr/sites/default/files/media/downloads/rapport-devaluation-inserm-21–05–25.pdf
(xvii). IGAS (2009). Le financement de la recherche, de l’enseignement et des missions d’intérêt général dans les établissements de santé. Accessed November 25, 2022. https://www.vie-publique.fr/sites/default/files/rapport/pdf/104000024.pdf
(xviii). Déclaration de Mme Marisol Touraine, ministre des affaires sociales et de la santé, sur le bilan de vingt ans du programme hospitalier de recherche clinique, Paris le 14 mars 2013. vie-publique.fr. Accessed October 18, 2022. https://www.vie-publique.fr/discours/187513-declaration-de-mme-marisol-touraine-ministre-des-affaires-sociales-et-d
(xix). Berta P.Avis n°374 sur le projet de loi de finances pour 2023 (n°273).Tome V. Recherche et enseignement supérieur. https://www.assemblee-nationale.fr/dyn/16/rapports/cion-cedu/l16b0374-tv_rapport-avis.pdf
(xx). Lallement R, Harfi M. Évaluation du Crédit d’impôt recherche – Rapport CNEPI 2021. https://www.strategie.gouv.fr/publications/evaluation-credit-dimpot-recherche-rapport-cnepi-2021
(xxi). OCDE (2020), “The effects of R&D tax incentives and their role in the innovation policy mix : Findings from the OECD microBeRD project, 2016–19”, OECD Science, Technology and Industry Policy Papers, n° 92, Éditions OCDE, Paris, https://doi.org/10.1787/65234003-en.
Ce texte a été relu par le Professeur Pierre Corvol qui déclare le lien d’intérêt suivant : présidence du Comité de pilotage scientifique de l’Agence Nationale de la Recherche
[1] Élaborée lors du Conseil européen de Lisbonne en mars 2000, cette stratégie visait à rendre l’UE plus compétitive dans de nombreux domaines : croissance, protection sociale, environnement, mais aussi recherche, avec un objectif de 3% du PIB consacrés au budget de la recherche.
[2] Cette société spécialisée en électronique médicale dont un des points forts était l’imagerie médicale, filiale de Thomson a été cédée à General Electric (GE) en 1987 en échange du rachat par Thomson de l’acticité électronique grand-public de GE.
[3] Les laboratoires P4 sont les seuls habilités à manipuler les agents pathogènes de classe 4, caractérisés par leur haute dangerosité (taux de mortalité très élevé en cas d’infection), l’absence de vaccin protecteur, l’absence de traitement médical efficace et la transmission possible par aérosols.
[4] Les agences de financement de la recherche allemandes et suisses, la DFG (Deutsche Forschungsgemeinschaft / Fondation allemande pour la recherche) et le FNS (fonds national suisse), ont une ligne récurrente pour ces investissements en infrastructures.
[5] Le Conseil stratégique des industries de santé a été créé en 2004, par le Gouvernement, dans le but d’établir un dialogue entre l’État et les industriels sur les moyens de maintenir et de renforcer l’attractivité de la France dans le secteur de la santé. L’année 2021 représente la 9e édition du Conseil.
[6] Les ingénieurs exercent au sein des équipes de recherche et des plateformes expérimentales une fonction essentielle : la maîtrise et le développement des technologies requises aux projets de recherche, fondées sur des outils en évolution permanente.
[7] Sans oublier que les primes n’entrent pas dans le calcul du montant de la retraite.
[8] Institut national de la santé et de la recherche médicale
[9] Centre national de la recherche scientifique
[10] Voir le dernier rapport Cnepi 2021 à ce sujet : Évaluation du Crédit d’impôt recherche – Rapport CNEPI 2021 | France Stratégie (strategie.gouv.fr)